
将一定量的氯气通入30mL浓度为10.00 mol·L-1的NaOH浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol ,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
C
【解析】
试题分析:因为反应后的溶液为NaCl、NaClO、NaClO3共存体系。在这几种物质中n(Na):n(Cl)= 1:1. n(NaOH)=0.03L×10.00 mol/L=0.3mol。所以与NaOH反应的氯气一定为0.3×1/2=0.15mol错误。B.假设n(Na+)=7mol,若n(Na+):n(Cl-)为7:3,则n(Cl-)=3mol。在反应的过程中电子转移3mol,而NaClO、NaClO3的物质的量的和为4,失去的电子的物质的量最小值为4,不符合电子守恒。错误。C.若反应中转移的电子为n mol ,则n(Cl-)=nmol;n(NaClO)+n(NaClO3)=(0.3-n)mol。若氧化产物全为NaClO ,根据电子守恒可得反应方程式:Cl2+2NaOH=NaCl+NaClO+H2O 可知:n(NaCl)=n(NaClO)=0.3mol÷2=0.15mol;若氧化产物全为NaClO3 ,根据电子守恒可得反应方程式:3Cl2+6NaOH=5NaCl+NaClO3+H2O 可知:n(NaCl)= 5n(NaClO)=0.3mol÷5/6=0.25mol;而事实上两种氧化产物都存在。因此存在关系:0.15<n<0.25。正确。D.若物质的关系为 n(NaCl):n(NaClO):n(NaClO3),则得到的电子的物质的量为1×11=11;而失去的电子的物质的量为1×2+1×5=7,得失电子数目不等,错误。
考点:考查氯气与NaOH溶液反应原理及电子转移的知识。


科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
下列物质不属于有机物的是
A. 乙酸 B. 碳酸钠 C. 乙醇 D. 乙烯
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
与氢氧根具有相同的质子数和电子数的微粒是
A.CH4 B.NH4+ C.NH2- D.Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使淀粉-KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
B.含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl-
C.c(H+)/c(OH-)=1012的溶液中:Al3+、NH4+、NO3-、K+
D.含有0.1mol·L-1HCO3-的溶液:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(15分)开发新型储氢材料是氢能利用的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4 +2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键 (填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为 ,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为 。
②与(HB=NH)3互为等电子体的分子为 (填分子式)
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为 。
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为 ,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为 。
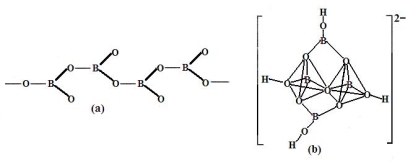
(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为 。
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是 。
③铜的单质中按ABCABC……方式堆积,设铜原子半径为a pm,则该晶体的密度为 g/cm3(阿伏伽德罗常数值为NA)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列事实、离子方程式及其对应关系均正确的是.
A.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O
B.向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
C.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH )2溶液等体积混合有白色沉淀生成:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.用铜电极电解饱和食盐水:2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(6分)有下列七种物质:①Cl2 ②Na2O2 ③H2O2 ④NH4Cl ⑤CH4 ⑥NaHSO4 ⑦Ne
回答下列问题
(1)不存在化学键的是_______________;(填序号)
(2)含有极性键和非极性键的是_______________;(填序号)
(3)NaHSO4固体溶于水,破坏了_____________键;其电离方程式为______________________
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:简答题
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
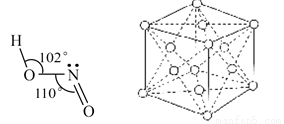
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个 键:
键:
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠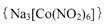 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
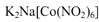 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态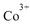 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA
C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑
D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com