
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 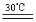 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如下:

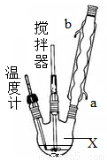
请回答下列问题:
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol?L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2?H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
(1)三颈烧瓶(1分) a(1分) (2)水浴加热(2分)
(3)否(1分) 因为铁与双氧水反应生成铁离子,而铁离子又促进双氧水分解(2分)
(4)过氧化尿素在温度高于45℃时会发生分解(2分)
(5)B(2分) (6)94%(2分) 偏高(1分)
【解析】
试题分析;冷凝管水的流向是下进上出。因此是从a口进入。三颈烧瓶一般选择水浴加热的方法进行加热。此反应中搅拌器不能选择体质材料,主要是铁与双氧水反应生成铁离子,而铁离子又促进双氧水分解。从题中列出的表格可知过氧化尿素在温度高于45℃时会发生分解。因此步骤①要采用减压蒸发。高锰酸钾滴定过氧尿素,主要是高锰酸钾与双氧水的反应。
由5 H2O2 + 2 KMnO4 + 3 H2SO4 = 8 H2O+2 MnSO4 + K2SO4+ 5 O2可知两摩尔的高猛酸性可以氧化五摩尔的双氧水,而题意中可知用了0.02乘以0.1等于0.002摩尔的高锰酸钾,根据比例关系可求出,此时消耗双氧水的物质的量为0.002乘以5再除以2得0.005摩尔。即过氧尿素的物质的量为0.005摩尔即质量为94乘以0.005等于0.47克,则产品中CO(NH2)2?H2O2的质量分数为0.47除以0.5等于94%
考点:考查化学实验仪器及基本操作的相关知识。


科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表。下列说法正确的是
元素 | 信息 |
X | K层电子数是L层电子数的2倍 |
Y | 一种核素在考古时常用来鉴定一些文物的年代 |
Z | 所处的周期序数与族序数相等 |
W | 最高价氧化物对应的水化物酸性最强 |
A.W的阴离子半径大于Z的阳离子半径
B.Y的氢化物比W的氢化物稳定
C.Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物
D.X在氧气中加热反应生成X2O2
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
决定化学反应速率的主要因素是
A.催化剂 B.参加反应的物质本身的性质
C.反应物的浓度 D.温度、压强以及反应物的接触面
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
下列说法正确的是
A.按系统命名法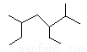 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质
C.若两种二肽互为同分异构体,则二者的水解产物一定不相同
D.等质量的甲烷、乙烯、1,3—丁二烯分别充分燃烧,所耗用氧气的量依次增加
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市毕业班综合测试三 理综化学试卷(解析版) 题型:填空题
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g)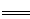 Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
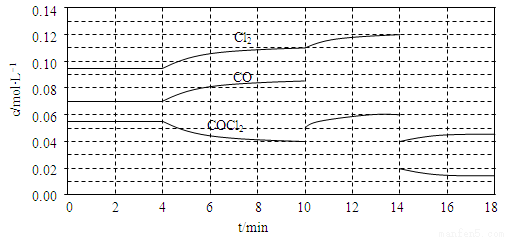
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S作沉淀剂,除去废水中的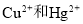
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
甲、乙、丙三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为6:2:3,则甲乙丙三种醇分子里的羟基数之比为
A.1:3:3 B.2:1:3 C.6:3:2 D.1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com