
某学习小组通过测定大理石与硝酸反应过程中体系质量的变化,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量均为25.0mL、大理石用量均为10.00g.
(1)请完成以下实验设计:
| 实验目的 | 实验编号 | T/K | 大理石规格 | c(HNO3) mol/L |
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) | ① | 298 | 粗颗粒 | 2.00 |
| ② | ||||
| ③ | ||||
| ④ |
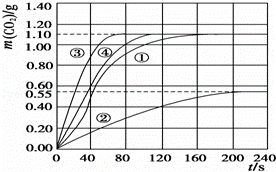
(2)实验①中CO2质量随时间变化的关系见下图:
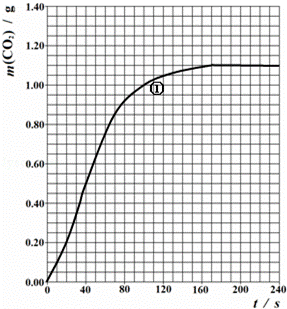
忽略溶液体积变化,计算实验①在40s﹣100s范围内HNO3的平均反应速率(保留2位小数): .
(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
考点:
探究影响化学反应速率的因素.
专题:
化学反应速率专题.
分析:
(1)根据实验的目的和影响化学反应速率的因素来设计实验;
(2)由CO2质量随时间变化的关系图得出40﹣100s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在40﹣100s范围内HNO3的平均反应速率;
(3)根据②、③的硝酸用量及温度、大理石规格,对比①画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
解答:
解:(1)由实验目的可知,探究浓度、接触面积对化学反应速率的影响,
则实验①②的温度、大理石规格相同,只有浓度不同;实验①③中只有温度不同,其它条件必须相同;实验①④中只有大理石规格不同,其它条件完全相同,
故答案为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L﹣1 |
| ② | 298 | 粗颗粒 | 1.00 |
| ③ | 308 | 粗颗粒 | 2.00 |
| ④ | 298 | 细颗粒 | 2.00 |
(2)由图可知40﹣100s,CO2生成的质量为m(CO2)=1.00g﹣0.50g=0.50g,物质的量为n(CO2)= mol≈0.0114mol,
mol≈0.0114mol,
由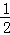 CaCO3+HNO3═
CaCO3+HNO3═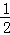 Ca(NO3)2+
Ca(NO3)2+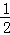 CO2↑+
CO2↑+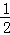 H2O可知,消耗HNO3的物质的量为n(HNO3)=0.0114mol×2=0.0228,
H2O可知,消耗HNO3的物质的量为n(HNO3)=0.0114mol×2=0.0228,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=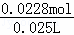 =0.912mol•L﹣1,
=0.912mol•L﹣1,
反应的时间t=100s﹣40s=60s
所以HNO3在70﹣90S范围内的平均反应速率为v(HNO3)=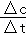 =
=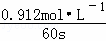 ≈0.015mol•L﹣1•S﹣1,
≈0.015mol•L﹣1•S﹣1,
故答案为:0.015mol•L﹣1•S﹣1;
(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;
③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为:
 ,
,
故答案为: .
.
点评:
本题考查化学反应速率的影响因素及反应速率的计算,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力.


科目:高中化学 来源: 题型:
化学反应经常伴随着颜色变化,下列有关反应中所观察到的颜色不正确的是( )
|
| A. | 酸性高锰酸钾溶液与足量乙烯反应,溶液由紫色变成无色 |
|
| B. | 二氧化氮气体通入水中,气体由红棕色变为无色 |
|
| C. | 热的氧化铜加入乙醇中,无色乙醇变绿色 |
|
| D. | 葡萄糖溶液与新制氢氧化铜共热,溶液由无色变成砖红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
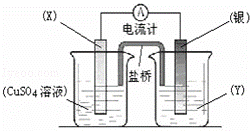
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能够说明亚硝酸(HNO2)为弱电解质的是( )
|
| A. | 0.1mol/L的亚硝酸水溶液的PH=2.1 |
|
| B. | 亚硝酸不与硫酸钠溶液反应 |
|
| C. | 25℃时,HNO2的水溶液的PH<7 |
|
| D. | 用亚硝酸做导电实验时,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
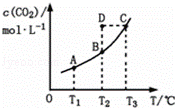
|
| A. | 反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0 |
|
| B. | 在T2时,若反应处于状态D,则一定有ν正<ν逆 |
|
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 |
|
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br﹣,SO42﹣,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是()
A. Br﹣ B. SO42﹣ C. H2SO3 D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()
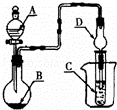
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液;分离以上各混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏 | B. | 萃取、分液、蒸馏 |
|
| C. | 萃取、蒸馏、分液 | D. | 分液、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(g)+B(g)C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com