
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
分析 (1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
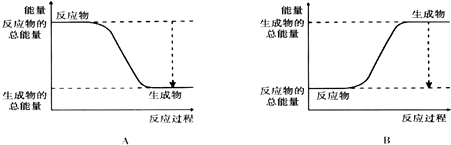
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(4)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答.
解答 解:(1)A.使用催化剂,加快反应速率,故A选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,
故答案为:A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,
△H=反应物中键能之和-生成物中键能之和=1368-1852=-484<0,该反应为放热反应.
故答案为:
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化 | |
| 拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | 放出热量 | 1852 |
| 总能量变化 | 放出热量 | 484 | |
点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| B. | 碳酸氢钠溶于盐酸:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- | |
| D. | 石灰石溶于硝酸:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com