



科目:高中化学 来源:不详 题型:填空题

 Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发 |
| B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现 |
| C.铜矿较易还原,铝矿很难还原 |
| D.以上说法是错误的 |
查看答案和解析>>
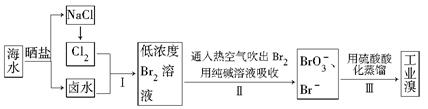
科目:高中化学 来源:不详 题型:填空题
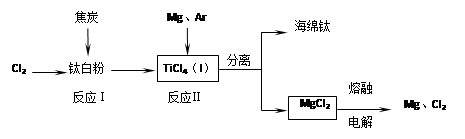
查看答案和解析>>
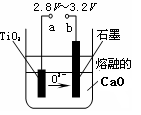
科目:高中化学 来源:不详 题型:填空题
 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 查看答案和解析>>
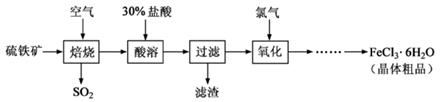
科目:高中化学 来源:不详 题型:填空题
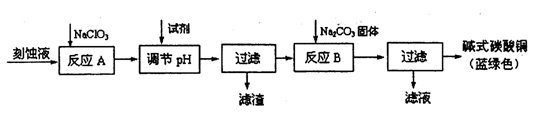
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 金属 | 存在形式 | 冶炼方法 |
| A | 金 | 游离态 | 金子比沙子密度大,利用水洗法直接分离 |
| B | 银 | 化合态 | 银的金属性弱,用加热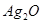 的方法冶炼 的方法冶炼 |
| C | 铁 | 化合态 | 铝的金属性比铁强,可用铝热法炼铁 |
| D | 钠 | 化合态 | 钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和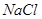 溶液方法冶炼 溶液方法冶炼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com