
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是正极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,电子有负极向正极移动 |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
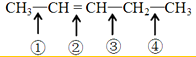 反应时断裂的化学键是( )
反应时断裂的化学键是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂是Cl2 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 上述反应中,每生成l mol SO42-,转移4 mol电子 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3N与盐酸反应时只生成一种盐NaCl | |
| B. | 在Na3N与水反应中Na3N是还原剂 | |
| C. | Na3N分子中Na+的半径比N3-的半径小 | |
| D. | Na+与N3-的电子层都与氩原子的结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有Na2O、Na2O2和NaHCO3 | B. | 一定含有Na2O和NaCl | ||
| C. | 不会有Na2CO3和NaCl | D. | 不会有NaHCO3和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| B. | 加强工业废水的排放监控,坚持达标排放 | |
| C. | 合理施用农药、化肥,以减少水体污染 | |
| D. | 淡水资源丰富,所以淡水可以取之不尽、用之不竭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液的体积 | B. | NaCl的质量分数 | ||
| C. | NaCl的物质的量 | D. | NaCl的物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com