
 ;(2)2Na2O2+2CO2=2Na2CO3+O2;(3) H2O;c(NO3-)>c(NH4+)>c(H+)>c(OH-);H2O2+2Fe2++ 2H+=2Fe3++2H2O;(4) 20,降低,减小。
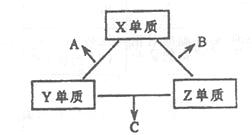
;(2)2Na2O2+2CO2=2Na2CO3+O2;(3) H2O;c(NO3-)>c(NH4+)>c(H+)>c(OH-);H2O2+2Fe2++ 2H+=2Fe3++2H2O;(4) 20,降低,减小。 ;(2) Na2O2和CO2反应的方程式是2Na2O2+2CO2=2Na2CO3+O2;(3)由于X、Y、Z分别都能与W可形成10电子化合物,Y的原子序数介于C、O,故W为H,Y为N。氢化物分别是CH4、NH3、H2O,由于后两者分子间可形成氢键,CH4分子间不能形成氢键,这三种化合物中沸点最髙的是H2O;W、Y、Z可形成离子化合物W4Y2Z3是NH4NO3,是一种强酸弱碱盐,NH4+在水中发生水解,溶液呈酸性,NH4+离子浓度减小,水溶液中各离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-);H2O2具有氧化性,能将Fe2+氧化为Fe3+,离子方程式为H2O2+2Fe2++ 2H+=2Fe3++2H2O;(4) 0.48molSO2和0.22molO2在2L密闭容器中反应达到平衡得到0.24 mol SO3,平衡时SO2、O2和SO3的浓度分别为0.12mol/L、0.05mol/L、0.12mol/L,则该反应的平衡常数为(0.12mol/L)2/[(0.12mol/L)2×0.05mol/L]=20,SO3的体积分数为0.12/(0.12+0.12+0.05)=0.41,O2转化率为0.06/0.11=6/11;若温度不变,再加人0.50 mol O2后,重新达到平衡,O2的转化率降低,平衡向右移动。
;(2) Na2O2和CO2反应的方程式是2Na2O2+2CO2=2Na2CO3+O2;(3)由于X、Y、Z分别都能与W可形成10电子化合物,Y的原子序数介于C、O,故W为H,Y为N。氢化物分别是CH4、NH3、H2O,由于后两者分子间可形成氢键,CH4分子间不能形成氢键,这三种化合物中沸点最髙的是H2O;W、Y、Z可形成离子化合物W4Y2Z3是NH4NO3,是一种强酸弱碱盐,NH4+在水中发生水解,溶液呈酸性,NH4+离子浓度减小,水溶液中各离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-);H2O2具有氧化性,能将Fe2+氧化为Fe3+,离子方程式为H2O2+2Fe2++ 2H+=2Fe3++2H2O;(4) 0.48molSO2和0.22molO2在2L密闭容器中反应达到平衡得到0.24 mol SO3,平衡时SO2、O2和SO3的浓度分别为0.12mol/L、0.05mol/L、0.12mol/L,则该反应的平衡常数为(0.12mol/L)2/[(0.12mol/L)2×0.05mol/L]=20,SO3的体积分数为0.12/(0.12+0.12+0.05)=0.41,O2转化率为0.06/0.11=6/11;若温度不变,再加人0.50 mol O2后,重新达到平衡,O2的转化率降低,平衡向右移动。 2SO3
2SO3

科目:高中化学 来源:不详 题型:单选题
| A.溶于水时HCl是强酸,H2S是弱酸 |
| B.受热时H2S能分解,HCl则不分解 |
| C.Fe与氯气反应生成FeCl3而Fe与S反应则生成FeS |
| D.Cl2能与H2S发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. X2YZ4 | B. XYZ3 | C. X3YZ4 | D.X4Y2Z7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2s<3s<4s | B.2px<2py<2pz |
| C.3s<3p<3d | D.2px=2py=2pz |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性:HCl<HBr | B.非金属性:Cl>Br |
| C.酸性:HClO4>HBrO4 | D.氧化性:Cl2>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com