
| 3.9g |
| 78g/mol |
| 3.9g |
| 78g/mol |
| 0.15mol |
| 0.1L |
| 0.35mol |
| 0.1L |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、12g金刚石中所含的共价键数为4NA |
| B、标准状况下,11.2L CCl4所含的分子数为0.5NA |
| C、46gNO2和N2O4的混合物含有的氮原子数为2NA |
| D、0.1mol O22-所含的电子数为1.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、HOCH2CH2OH |
C、 |
D、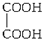 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷管和电极材料等. |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有3种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
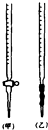 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、NH3?H2O |
| C、AgNO3 |
| D、BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com