
(17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
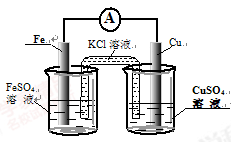
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。

②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
(17分)(1)Cu2++2H2O Cu(OH)2+2H+(2分);
Cu(OH)2+2H+(2分);
(2)(12分)①(见图,共4分,标对1个2分)
②CH4(2分) O2+4e-+2H2O(3分)13(3分);
(3)(3分)存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq)[1分],其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀[1分],使得上述溶解平衡继续向右移动 [1分]。[或用平衡FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+(aq)解释]
Fe 2+(aq)+ S 2-(aq)[1分],其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀[1分],使得上述溶解平衡继续向右移动 [1分]。[或用平衡FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+(aq)解释]
【解析】
试题分析:(1)CuSO4是强酸弱碱盐,Cu2+水解消耗水电离产生的OH-,产生Cu(OH)2使溶液显酸性,为了抑制盐的水解,所以要加入少量的硫酸,用方程式表示是Cu2++2H2O Cu(OH)2+2H+;(2)①根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,则Fe要插在FeSO4溶液中,Cu插在CuSO4溶液中,用图表示是
Cu(OH)2+2H+;(2)①根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,则Fe要插在FeSO4溶液中,Cu插在CuSO4溶液中,用图表示是 ;
;
②想在II中实现铁上镀铜,Fe应该作阴极,与电池的负极连接,则应在a处通入CH4;在b处通入空气,在b电极上发生的电极反应式为O2+4e-+2H2O =4OH-;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,电解的方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH,n(NaCl)=0.1mol,在阳极Cl-放电,若Cl-完全放电,应该产生气体0.05mol,而实际产生的气体的物质的量是n(气体)=0.448L÷22.4L/mol=0.02mol<0.05mol,说明Cl-没有反应完全。根据方程式可知:n(NaOH):n(Cl2)=2:1,n(Cl2)= 0.02mol,所以n(NaOH)=0.04mol,因此c(NaOH)= n(NaOH)÷V=0.04mol÷0.4L=0.1mol/L,所以c(H+)=Kw÷c(OH-)=1×10-13mol/L, pH=13;(3)当把FeS加入工业废水中后,FeS在水中溶解、电离,存在溶解平衡:FeS(s)
Cl2↑+H2↑+2NaOH,n(NaCl)=0.1mol,在阳极Cl-放电,若Cl-完全放电,应该产生气体0.05mol,而实际产生的气体的物质的量是n(气体)=0.448L÷22.4L/mol=0.02mol<0.05mol,说明Cl-没有反应完全。根据方程式可知:n(NaOH):n(Cl2)=2:1,n(Cl2)= 0.02mol,所以n(NaOH)=0.04mol,因此c(NaOH)= n(NaOH)÷V=0.04mol÷0.4L=0.1mol/L,所以c(H+)=Kw÷c(OH-)=1×10-13mol/L, pH=13;(3)当把FeS加入工业废水中后,FeS在水中溶解、电离,存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq),由于在溶液中存在Cu2+,而且c(Cu2+)·c(S 2-)>Ksp(CuS),所以其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
Fe 2+(aq)+ S 2-(aq),由于在溶液中存在Cu2+,而且c(Cu2+)·c(S 2-)>Ksp(CuS),所以其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
考点:考查盐的水解、电化学反应原理的应用、溶液pH的计算、沉淀溶解平衡在处理废水的应用的知识。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
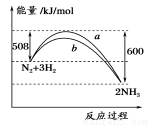
A.加入催化剂,该化学反应的反应热改变
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2+3H2? ?2NH3,ΔH=-92 kJ/mol
?2NH3,ΔH=-92 kJ/mol
D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:填空题
(16分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)

请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色
C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到Fe2O3固体
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
下列陈述I、 II正确并且有因果关系的是( )
选项 | 叙述I | 叙述II |
A | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.强电解质一定易溶于水
B.钢铁在海水中发生电化腐蚀时,铁是负极被氧化
C.对可逆反应,升高温度一定存在v(正)>v(逆)
D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:实验题
(17分)化学兴趣小组的同学设计实验探究浓硫酸与木炭反应后产生气体的成分。
(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:____________________。
【装置设计】组装如下的实验装置,然后进行实验探究。

(2)装入反应物之前,必须先 。
(3)要验证产生的气体中含有CO2,请在答题卡中完成图中虚线框内的装置简图,并标明试剂。
【实验探究】
(4)观察实验,完成实验现象的部分记录:
实验装置 | ① | ② | ③ |
实验现象 |
| …… |
|
(5)实验装置②中品红溶液Ⅰ的作用 ,III的作用 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
A.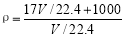 B.
B.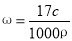
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
区别溶液和胶体最简单的方法是
A、丁达尔现象 B、闻气味
C、过滤 D、根据分散质微粒直径
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com