
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
|
| A. |
放出碘的苯溶液 | B. |
氧化I﹣ | C. |
将海带灼烧 | D. |
过滤含I﹣溶液 |
| 物质的分离、提纯的基本方法选择与应用.. | |
| 专题: | 化学实验基本操作. |
| 分析: | A.苯的密度比水小,应从分液漏斗上口倒出; B.电离子可被过氧化氢氧化; C.应在坩埚中灼烧; D.应用玻璃棒引流. |
| 解答: | 解:A.碘的苯溶液在分液漏斗中位于上层,应待下层液体放出后从上口倒出,故A错误; B.过氧化氢具有强氧化性,可氧化碘离子生成碘单质,故B正确; C.不能在烧杯中高温灼烧固体,烧杯易炸裂,固体的灼烧应在坩埚中,故C错误; D.过滤应用玻璃棒引流,防止浊液外漏,故D错误. 故选A. |
| 点评: | 本题考查化学实验操作,题目难度不大,物质的分离方法取决于物质的性质,根据物质的性质的异同选取分离方法. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示。

(1)A分子的电子式是________;D中官能团名称是________。
(2)在反应①~⑥中,属于加成反应的是________;属于取代反应的是________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法
________________________________________________________________________
________________________________________________________________________(填一种即可)
用于鉴别B、D和甲的一种试剂是________。
(4)写出下列反应的化学方程式:
G―→B+E:___________________________________________________;
A―→F:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH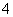
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件中,两种气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO
D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO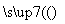 CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )

|
| A. | 元素甲的简单气态氢化物稳定性比乙的强 |
|
| B. | 元素乙在周期表中的位置为第2周期,VIA族 |
|
| C. | 元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
|
| D. | 4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):
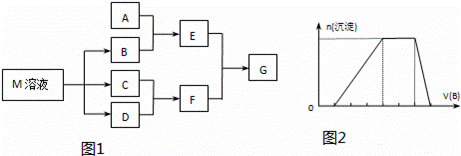
(1)写出用惰性电极电解M溶液的离子方程式 .
(2)写出F的电子式 .
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 .
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 .
(6)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)  CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A.该反应的△H > 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D. t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,
则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
A. H2O2、ZnO B.氨水 C.KMnO4、ZnCO3 D.NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com