
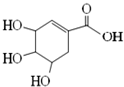
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
分析 该分子中含有醇羟基、碳碳双键和羧基,具有醇、烯烃和羧酸性质,能发生氧化反应、消去反应、加成反应、加聚反应、酯化反应、取代反应等,据此分析解答.
解答 解:A.根据结构简式确定分子式为C7H10O5,故A错误;
B.该分子中含有醇羟基、碳碳双键和羧基三种官能团,故B错误;
C.该分子的不饱和度是3,苯环的不饱和度是4,所以该分子的同分异构体中可能含有酯基和醛基,不可能含有苯环,故C正确;
D.能和钠反应的有醇羟基和羧基,只有羧基能和NaOH反应,所以该化合物与足量的钠、NaOH反应得到的钠盐产物不同,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查醇和羧酸性质,注意该分子中没有酚羟基,易错选项是C.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
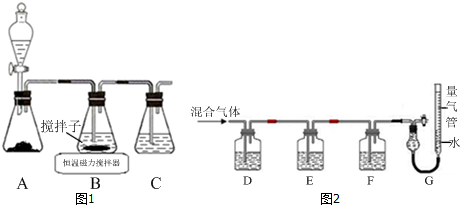
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
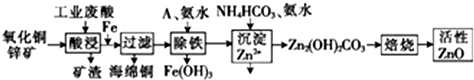
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.7 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
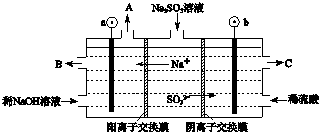
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | B. | B的转化率为60% | ||
| C. | A的平衡浓度是2.8mol/L | D. | 平衡时气体的压强是原来的0.94倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
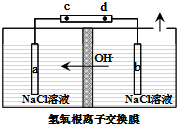 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
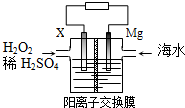
| A. | X可为铁、铜、石墨等电极 | |
| B. | 每转移2 mol电子,2mol H+由交换膜左侧向右侧迁移 | |
| C. | 正极的电极反应式为H2O2+2e-+2H+═2H2O | |
| D. | 该电池能将化学能全部转化成电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com