
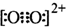
| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| a3cm3 |
| 160 |
| NA?a3 |
| 160 |
| NA?a3 |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
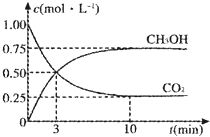 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
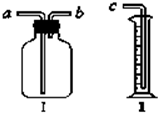 (1)用它作为气体收集装置:若从a端进气可收集的有
(1)用它作为气体收集装置:若从a端进气可收集的有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液与过量氨水 |
| B、NaOH溶液与AlCl3溶液 |
| C、NaAlO2溶液与盐酸 |
| D、少量CO2通入CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com