
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.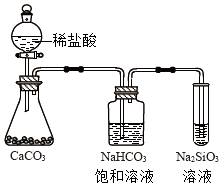
如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
【答案】C
【解析】解:A.非金属性O>N>Si,气态氢化物的稳定性:H2O>NH3>SiH4 , 故A正确;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确;
C.利用最高价含氧酸的酸性比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误;
D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8,则118号元素在周期表中位于第七周期0族,故D正确;
故选C.
A.非金属性越强,对应氢化物越稳定;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物;
C.发生强酸制取弱酸的反应,且HCl不是最高价含氧酸;
D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 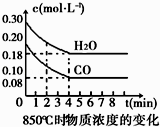
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (gCO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①△H(填“>”、“<”或“=”)0.
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ![]() ,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
③图中的B点处,NH3的平衡转化率 为 . 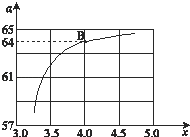
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 将Cl2通入氯化亚铁溶液:Fe2++Cl2![]() Fe3++2Cl-
Fe3++2Cl-
B. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. FeCl3溶液中通入过量的氨水: Fe3++3OH-![]() Fe(OH)3↓
Fe(OH)3↓
D. Cl2通入烧碱溶液中:Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 .
(2)由图1和图2判断使用硫杆菌的最佳条件为 . 若反应温度过高,反应速率下降,其原因是 . 
(3)方法2:在一定条件下,用H2O2氧化H2S
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 .
(4)Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理 .
(5)方法2:用氨水除去SO2
已知25℃,NH3H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0molL﹣1 , 溶液中的c(OH﹣)=molL﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 molL﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
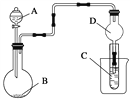
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( ) 
A.b含有分子内氢键
B.b中Ca2+的配位数为4
C.b含有共价键、离子键和配位键
D.a和b中的N原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com