
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
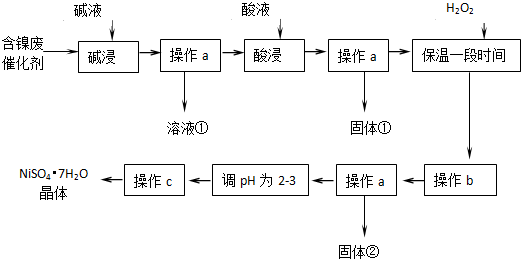
分析 由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%),原料中加入碱溶液,铝元素溶解,碱浸后过滤得到固体中应含有镍、铁的化合物,酸浸后过滤,滤液中含有亚铁离子、铁离子、镍离子,加入过氧化氢将亚铁离子氧化为铁离子,调节溶液PH使铁离子生成氢氧化铁沉淀,镍离子不沉淀,再过滤后,调节滤液PH值为2-3防止镍离子水解,得硫酸镍溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,
(1)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强碱反应溶解得到溶液含有偏铝酸盐;
(2)依据最后制备NiSO4•7H2O,防止引入其他杂志离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子、铁离子和镍离子;
(3)加入过氧化氢氧化亚铁离子为铁离子,铁离子易转化为沉淀除去;
(4)依据氢氧化物沉淀的PH分析判断,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液;
(5)正极上NiOOH得电子生成Ni(OH)2.
解答 解:由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%),原料中加入碱溶液,铝元素溶解,碱浸后过滤得到固体中应含有镍、铁的化合物,酸浸后过滤,滤液中含有亚铁离子、铁离子、镍离子,加入过氧化氢将亚铁离子氧化为铁离子,调节溶液PH使铁离子生成氢氧化铁沉淀,镍离子不沉淀,再过滤后,调节滤液PH值为2-3防止镍离子水解,得硫酸镍溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,
(1)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O;
(2))“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4•7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,则酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+;
故答案为:H2SO4;
(3)铁离子易转化为沉淀除去,加入过氧化氢氧化亚铁离子为铁离子,其反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2-7.1间,
故答案为:3.2-7.1;
(5)NiMH电池放电过程中,正极上NiOOH得电子生成Ni(OH)2,则正极的电极方程式为:NiOOH+H2O+e-=Ni(OH)2+OH-,
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查了物质分离的实验设计和方法应用、溶度积常数的有关计算,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,铝及其化合物性质分析判断,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠在水层中反应并四处游动 | |
| B. | 钠在苯与CuSO4溶液的界面处反应并作上下跳动 | |
| C. | 烧杯中有气泡产生 | |
| D. | 烧杯底部有蓝色沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 | |
| B. | 纯银打造的饰品放置一段时间后表面会生成一层黑色物质 | |
| C. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| D. | 镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
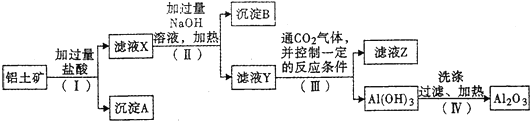
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
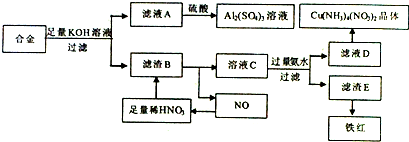

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
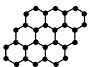 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
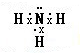 ,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti核外电子数相等 | |
| C. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti组成的金属钛单质互称为同位素 | |
| D. | ${\;}_{22}^{48}$Ti与${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com