
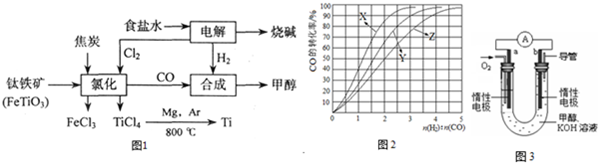
���� ��1��������ͼ��֪��FeTiO3�ڸ������뽹̿��������Ӧ�õ����Ȼ��ѣ��������Ȼ�����CO��
��2���ɸ�˹���ɣ��١�2-�ڿɵã�2Mg��s��+TiCl4��l���T2MgCl2��s��+Ti��s������Ӧ��Ҳ������Ӧ���㣻
��3������ϳɼ״�ʱ��ҪCO��H2�����ʵ����������Ȼ����̷���ʽ������Ҫ�������ʵ������������������ʵ��������ⱥ��ʳ��ˮ�����������������ʵ������ɵ���Ҫ�������������ʵ�����
��4������Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ��ת����ԽС��ѡ����¶�ӦʹCO������ת����
��5���ټ���Ũ���̣���ƽ�ⳣ���Ƚ��жϷ�Ӧ���з���������ȷ�����淴Ӧ���ʹ�ϵ��
�ڷ�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У�
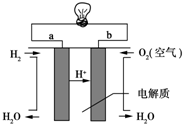
��6������װ��ͼ����֪aΪ������bΪ������ԭ�����������������
�ڵ�ط�ӦΪ�״���������Ӧ����̼��ء�ˮ����ϵ���غ���д���ӷ���ʽ��
��� �⣺��1���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѣ��������Ȼ�����CO���÷�Ӧ��ѧ����ʽΪ��2FeTiO3+6C+7Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3+2TiCl4+6CO��
�ʴ�Ϊ��2FeTiO3+6C+7Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3+2TiCl4+6CO��
��2����֪����Mg��s��+Cl2��g��=MgCl2��s����H=-641KJ/mol
��Ti��s��+2Cl2��g��=TiCl4��g����H=-770KJ/mol
�ɸ�˹���ɣ��١�2-�ڵõ��Ȼ�ѧ����ʽΪ��2Mg��s��+TiCl4��l���T2MgCl2��s��+Ti��s�����ʡ�H=��-641kJ/mol����2-��-770 kJ/mol��=-512kJ/mol��
�ʴ�Ϊ��-512kJ/mol��
��3�����ɼ״������ʵ���Ϊ$\frac{192��1{0}^{6}g}{32g/mol}$=6��106mol����CO+2H2��CH3OH ��֪����ҪCOΪ6��106mol����Ҫ����Ϊ12��106mol����2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO����֪��Ҫ����Ϊ6��106mol��$\frac{7}{6}$=7��106mol����2NaCl+2H2O  2NaOH+H2��+Cl2������֪�����������Ϊ7��106mol������Ҫ���������Ϊ��12��106mol-7��106mol=5��106mol������Ҫ��������Ϊ5��106mol��2g/mol=10��106g=10t��
2NaOH+H2��+Cl2������֪�����������Ϊ7��106mol������Ҫ���������Ϊ��12��106mol-7��106mol=5��106mol������Ҫ��������Ϊ5��106mol��2g/mol=10��106g=10t��
�ʴ�Ϊ��10��
��4���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���CO��ת����ԽС�����ͼ���֪��230���ʵ��������Ӧ��������X��
230��ʱ����ҵ������õĺϳ������n��H2����n��CO���ı�ֵΪ2.5〜3ʱ��COת�����Ѿ��ܸߣ���ѡB��
�ʴ�Ϊ��X��B��
��5��������ʼʱc��CO��=1mol/L��c��H2O��=2mol/L����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol/L
H2O��g��+CO��g��?H2��g��+CO2��g��
��ʼ����mol/L����2 1 0 0
�仯����mol/L����0.5 0.5 0.5 0.5
ijʱ�̣�mol/L����1.5 0.5 0.5 0.5
Qc=$\frac{0.5��0.5}{1.5��0.5}$=$\frac{1}{3}$��K=1���ʷ�Ӧ������У���ʱ�÷�Ӧv��������v���棩��
�ʴ�Ϊ������
�ڷ�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������У��÷�Ӧ��ƽ�ⳣ��Kֵ������
�ʴ�Ϊ������
��6����װ��ͼ������֪aΪ������bΪ�������õ�ع���ʱ��OH-��b���ƶ���
�ʴ�Ϊ��b��
�ڵ�ط�ӦΪ�״���������Ӧ����̼��ء�ˮ����Ӧ�����ӷ���ʽΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
���� ���⿼�黯ѧ�������̡���Ӧ�ȼ��㡢��ѧ���㡢��ѧƽ��ͼ��ƽ�ⳣ��Ӱ��������Ӧ�á����ԭ���ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ�����


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ƽ��ȡ8.75 gʳ�� | |
| B�� | ��25 mL��Ͳ��ȡ12.36 mL���� | |
| C�� | �ù㷺pH��ֽ���ij��ҺpHֵΪ3.5 | |
| D�� | �¶ȼ�����ʾ�����¶���Ϊ25.6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӡ������ӡ�������Ϊ����ɫ���������ӱ���ԭ�ӽṹ�ȶ� | |
| B�� | ��ԭ���õ��ӣ�����Cl2�ڻ�ѧ��Ӧ����Ԫ�ػ��ϼ�ֻ�ή�� | |
| C�� | ��ԭ�ӡ������ӡ�����������ԭ�ӵ��������ﵽ8���ӽṹ | |
| D�� | ��Ԫ������Ȼ���в���������̬��ֻ�Ի���̬��ʽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  1��3��4-���ױ� 1��3��4-���ױ� | B�� |  2-��-2-�ȱ��� 2-��-2-�ȱ��� | ||
| C�� |  2-��-1-���� 2-��-1-���� | D�� | 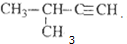 2-��-3-��Ȳ 2-��-3-��Ȳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
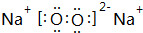 ���û������л�ѧ�����������Ӽ������ۼ���
���û������л�ѧ�����������Ӽ������ۼ���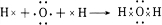 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 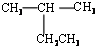 2-�һ����� 2-�һ����� | B�� | CH3CH2CH2CH2OH 1-���� | ||
| C�� | 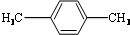 ����ױ� ����ױ� | D�� | 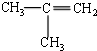 2-��-2-��ϩ 2-��-2-��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
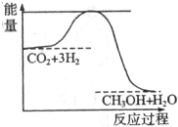
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
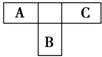 A��B��CΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ��
A��B��CΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ�� ��C�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽΪ2F2+2H2O=4HF+O2��
��C�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽΪ2F2+2H2O=4HF+O2���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com