
3I﹣+S2O82﹣=I3﹣+2SO42﹣的反应速率可以用I3﹣与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I﹣)/mol•L﹣1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82﹣)/mol•L﹣1 | 0.040 | 0.040 | 0.080 | c1 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 22.0 | t2 |
下列说法不正确的是( )
|
| A. | 该实验的目的是探究I﹣与S2O82﹣浓度对反应速率的影响 |
|
| B. | 若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s |
|
| C. | 实验④c1=0.020 mol•L﹣1 |
|
| D. | 实验⑤显色时间t2=11 s |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
A、由题目中表格数据可分析出c(I﹣)、c(S2O32﹣)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I﹣与S2O82﹣的浓度对反应速率的影响;
B、对比数据组①和②、数据组②和③、数据组③和④、数据组①和③,分析当其中一个变量(即一种反应物浓度)保持不变时,反应时间的变化(即反应速率的变化),然后分析当两个变量同时变化一定的倍数时,反应时间的变化(即反应速率的变化),就可以得出其中的规律,据此计算t2;
C、升高温度反应速率加快,所以显蓝色所需时间越少;
D、表中数据是温度一定,究反应物I﹣与S2O82﹣的浓度对反应速率的影响.
解答:
解:A、由题目中表格数据可分析出c(I﹣)、c(S2O32﹣)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I﹣与S2O82﹣的浓度对反应速率的影响,故A正确;
B、升高温度反应速率加快,所以显蓝色所需时间减少,40℃下进行编号③对应浓度的实验,显色时间t2的范围为<22.0s,故B正确;
C、对比数据组①和④,可以看到,(I﹣)增大到4倍时,反应时间为原反应时间的四分之一,即反应速率加快了4倍,所以c1=0.040 mol•L﹣1,故C错误;
D、对比数据组①和②,可以看到,c (S2O82﹣)不变,c (I﹣)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比数据组②和③,可以看到,c (I﹣)不变,c (S2O82﹣)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;
对比数据组①和③,可以看到,c (I﹣)和c (S2O82﹣)均增大到2倍时,反应时间为原反应时间的四分之一,即反应速率加快了4倍.
可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,可得出结论:反应速率与反应物起始浓度乘积成正比.
对比实验①和⑤,实验⑤的c (I﹣)为实验①的4倍,而c (S2O82﹣)为实验①的2倍,则由此可计算实验⑤的反应时间应为实验①反应时间的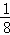 ,即t1=88s×
,即t1=88s×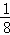 =11s,故D正确;
=11s,故D正确;
故选C.
点评:
本题通过陌生情景考查化学反应速、影响化学反应速率的外界因素(浓度)、学生对图表的观察、分析以及学生对实验数据的分析、整理、归纳等方面的思维能力,难度较大,解决该类试题应注意:①认真审题,明确实验目的,理解直接测量与实验目的间的逻辑和数学关系;②理解控制变量的思想在实验设计和数据分析中的运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
根据下列反应的化学方程式,判断有关物质的还原性强
弱顺序是( )
①I2 + SO2 + 2H2O = H2SO4 + 2HI; ② 2FeCl2 + Cl2 = 2FeCl3;
③2 FeCl3 + 2HI = 2FeCl2 + 2HCl+I2
FeCl3 + 2HI = 2FeCl2 + 2HCl+I2
A.SO2>I->Fe2+>Cl- B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.I->Fe2+>Cl->SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ•mol﹣1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
则X、Y、Z的电负性从大到小的顺序为( )
|
| A. | Z>Y>X | B. | X>Z>Y | C. | X>Y>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学的说法正确的是( )
|
| A. | 需要加热才能发生的反应是吸热反应 |
|
| B. | 等量的金刚石和石墨固体分别完全燃烧,前者放出热量多,说明金刚石更稳定 |
|
| C. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
|
| D. | 由热化学方程式 3H2(g)+N2(g)⇌2NH3(g)△H=﹣92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于pH的说法正确的( )
|
| A. | 强酸溶液的pH值一定比弱酸溶液小 |
|
| B. | pH值等于7的溶液,一定是中性的溶液 |
|
| C. | 常温下,由水电离出的c(H+)=10﹣12mol/L,则溶液pH一定为12 |
|
| D. | 常温下,pH=10的氨水溶液中,OH﹣总浓度与由水电离出的OH﹣浓度之比为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2 L的戊烷所含的分子0.5NA
B. 28 g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
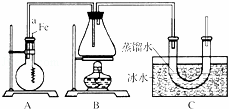
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
(1)写出制取溴苯的化学方程式: .
(2)步骤③中观察到的现象是: .
(3)C装置中U形管内部用蒸馏水封住管底的作用是: .
(4)反应完毕后,U形管内的现象是: .分离溴乙烷时所用的最主要仪器的名称是(只填一种) .
(5)实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有 (填化学式).欲得到无色的溴苯的方法是 (填试剂和操作名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.08mol•L﹣1,则下列判断正确的是( )
|
| A. | C1:C2=1:3 |
|
| B. | 平衡时,H2和NH3的生成速率之比为2:3 |
|
| C. | N2、H2的转化率之比为1:3 |
|
| D. | C1的取值范围为0.04mol•L﹣1<Cl<0.14mol•L﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com