
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA (提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
分析 A.铝失去电子生成三价铝离子;
B.质量转化为物质的量,结合1个氨气分子含有10个电子;
C.质量转化为物质的量,结合1个氢气分子含有2个原子;
D.常温常压,Vm≠22.4L/mol.
解答 解:A.2.7g金属铝物质的量为$\frac{2.7g}{27g/mol}$=0.1mol,变成铝离子时失去的电子数目为0.3NA,故A错误;
B.17g氨气物质的量为$\frac{17g}{17g/mol}$=1mol,所含的电子数目为10NA,故B正确;
C.2g氢气物质的量为$\frac{2g}{2g/mol}$=1mol,所含原子数目为2NA,故C错误;
D.常温常压,Vm≠22.4L/mol,11.2L氮气物质的量不是0.5mol,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的判断及计算,注意明确标况下气体摩尔体积的使用条件,掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
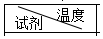 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
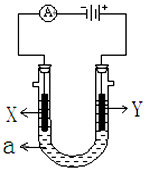 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
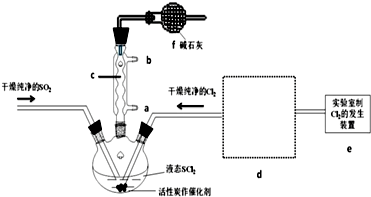
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 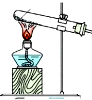 | 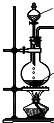 | 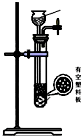 | 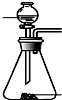 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4 | 4mol/LHNO3+NaHSO3 | 70%NaHSO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com