
| A. | CO2 | B. | CaO | C. | Na2O2 | D. | Al2O3 |
分析 碱性氧化物是指能跟酸起反应,生成盐和水的氧化物.一般来说金属氧化物大部分是碱性氧化物,而且碱性氧化物一定是金属氧化物.
解答 解:碱性氧化物是指能和酸反应生成盐和水的氧化物,
A、属于酸性氧化物,故A错误;
B、氧化钙是碱性氧化物,它能和酸反应生成盐和水,且为氧化物,故B正确;
C、过氧化钠能与酸反应产物是盐、水以及氧气,不属于碱性氧化物,故C错误;
D、氧化铝既能和酸之间反应还能和碱之间反应,属于两性氧化物,不属于碱性氧化物,故D错误.
故选B.
点评 碱性氧化物是指能与酸起反应生成盐和水的氧化物,大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
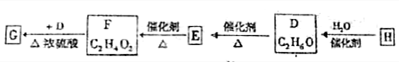

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
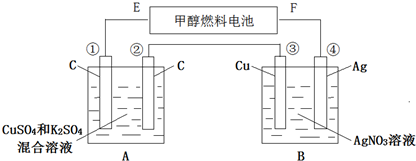
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁晶体需在氯化氢气流的氛围中加热失水制得无水氯化镁 | |
| B. | 夏天,打开碳酸饮料会有较多气泡溢出 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产氨气时,采用高温和催化剂等条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极的电极反应式为:O2+4H++4e-═2H2O | |
| B. | 溶液中阴离子向正极移动 | |
| C. | 负极的电极反应式为:N2H4+4OH--4e-═4H2O+N2 | |
| D. | 电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
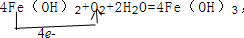 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com