
| A. | Fe+CuSO4═FeSO4+Cu | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | NaOH+HCl═NaCl+H2O |
分析 单质与化合物反应生成新单质、化合物的反应,为置换反应,以此来解答.
解答 解:A.Fe+CuSO4═FeSO4+Cu为置换反应,故A选;
B.2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑为分解反应,故B不选;
C.S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2为化合反应,故C不选;
D.NaOH+HCl═NaCl+H2O为复分解反应,故D不选;
故选A.
点评 本题考查四种基本反应类型,为高频考点,把握物质的类别、基本反应类型的判断为解答的关键,侧重分析与应用能力的考查,注意化学反应的分类法,题目难度不大.


科目:高中化学 来源: 题型:解答题
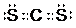 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 括号内为杂质 | 实验操作或方法 | |
| A | NO2(NO) | 通入O2 |
| B | CuSO4溶液(硫酸铁) | 加入足量CuO,过滤 |
| C | 溴苯(溴) | 加入NaOH溶液,分液 |
| D | MnO2(I2) | 加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |
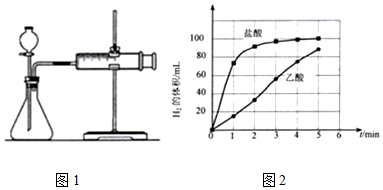
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
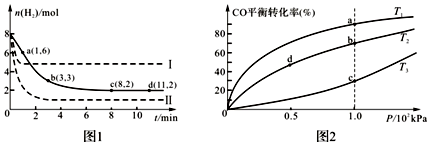
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 88.0gCO2与N2O的混合物中所含中子数为44NA | |
| B. | 0.1L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数等于0.2NA | |
| C. | 100mL12mol•的浓HNO3与过量的Cu反应转移电子的数目为0.6NA | |
| D. | 46g乙醇中存在的共价键总数为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com