
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
分析 (1)①中等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐;溶液中的氢氧根离子是水电离的,根据常温下水的离子积计算出由水电离出的c(OH-);(2)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol/L;b中溶液pH=7,说明c(H+)=c(OH-),结合电荷守恒分析离子浓度关系;
(3)第③组混合溶液中溶质为HA、NaA,该溶液显酸性,说明HA的电离程度大于NaA的水解程度;溶液中c(A-)>c(Na+);
(4)加水稀释溶液的碱性减弱,pH减小,稀释100倍,pH变化小于2个单位;
(5)盐为强电解质,完全电离,HA为弱电解质,部分电离,强碱弱酸盐易水解,但较微弱.
解答 解:(1)①中等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐,说明HA为弱酸,A-在溶液中水解显碱性,其水解方程式为:A-+H2O?HA+OH-;由a组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,所以水电离的溶液中的c(OH-)=10-5mol/L,
故答案为:A-+H2O?HA+OH-;10-5;
(2)若该酸为强酸,等体积等浓度混合时pH=7,而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度应该大于0.2mol/L;
溶液的pH=7,溶液中c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)=c(Na+),
故答案为:>;=;
(3)第③组混合溶液中溶质为HA、NaA,HA电离出氢离子,NaA水解生成氢氧根离子,该溶液显酸性,说明HA的电离程度大于NaA的水解程度;溶液中c(A-)>c(Na+),由于水解和电离的程度较小,所以溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-);
故答案为:>;c(A-)>c(Na+)>c(H+)>c(OH-);
(4)NaA水解显碱性,加水稀释溶液的碱性减弱,pH减小,稀释100倍,pH变化小于2个单位,B曲线符合;
故答案为:B;
(5)NaA为强电解质,完全电离,HA为弱电解质,部分电离,NaA易水解,但较微弱,所以等浓度的NaA和HA中A-浓度盐中大于酸,所以A-离子浓度由大到小的顺序为:乙>丁>甲>丙,
故答案为:乙>丁>甲>丙.
点评 本题考查了离子浓度大小的比较、弱电解质的电离等知识点,题目难度中等,注意掌握溶液酸碱性的定性判断方法,根据①确定酸的强弱,再结合电荷守恒、盐的水解原理等知识进行分析解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ①③④⑥ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
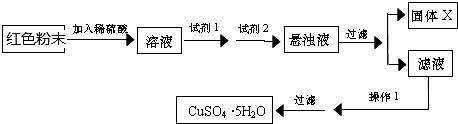
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
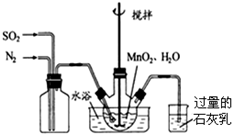
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com