
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.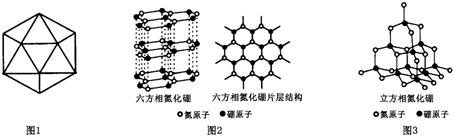
分析 (1)由图及元素守恒可写出由B2O3制备BF3的方程式;根据价层电子对互斥理论确定构型和杂化方式;
(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(3)在[Al(OH)4]-中Al采取sp3杂化,用最外层的四个空轨道接受O提供的孤对电子形成配合物,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,据此计算;
(4)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个等边三角形拥有的顶点为:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12,每2个面共用一个B-B键;
(5)①a.由图可知立方相氮化硼是立体网状结构,为原子晶体;
b.非金属元素之间易形成共价键;
c.六方相氮化硼为层状结构,层间为分子间作用力,作用力小;
d.立方相氮化硼含有σ键不存在π键;
②六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,该物质的层状结构中不存在自由移动的电子;
③氮化硼与碳元素的单质相似,结合金刚石的结构进行判断,立方相氮化硼晶体中,每个硼原子连接12个六元环,在地壳内部,离地面越深,其压强越大、温度越高.
解答 解:(1)B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为:B2O3+3CaF2+3H2SO4=2BF3↑+3CaSO4+3H2O,BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,中心原子B原子的价层电子对数为3,属于sp2杂化,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子为平面三角形,
故答案为:B2O3+3CaF2+3H2SO4=2BF3↑+3CaSO4+3H2O;sp2;平面正三角形;
(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,B、N、O、F元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O,B的第一电离能最小,第一电离能由大到小的顺序是:F>N>O>B,
故答案为:F>N>O>B;
(3)在[Al(OH)4]-中Al采取sp3杂化,用最外层的四个空轨道接受O提供的孤对电子形成配合物,其结构式为 ,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,即2NA个配位键,
,一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,即2NA个配位键,
故答案为: ;2NA;
;2NA;
(4)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个面拥有这个顶点的:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12,每2个面共用一个B-B键,每个面拥有这个B-B键的$\frac{1}{2}$,每个等边三角形占有的B-B键为:$\frac{1}{2}$×3=$\frac{3}{2}$,20个等边三角形拥有的B-B键为:$\frac{3}{2}$×20=30,
故答案为:30;
(5)①(2)a.立方相氮化硼为空间网状结构,不存在分子,为原子晶体,故a错误;
b.非金属元素之间易形成共价键,所以N原子和B原子之间存在共价键,故b正确;
c.六方相氮化硼层间为层状结构,分子间作用力,作用力小,导致其质地软,故c正确;
d.立方相氮化硼N原子和B原子之间存在共价单键,所以该化合物中含有σ键不存在π键,故d错误;
故选ad;
②六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,六方相氮化硼晶体内B-N键数与硼原子数之比为3:1,该物质的层状结构中不存在自由移动的电子,所以不导电,
故答案为:3:1;立方氮化硼晶体内无自由移动的电子;
③氮化硼与金刚石的结构相似,立方相氮化硼晶体中,每个硼原子连接12个六元环,在地壳内部,离地面越深,其压强越大、温度越高,根据题干知,实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压,
故答案为:12;高温、高压.
点评 本题考查了物质结构和性质,涉及第一电离能、原子的杂化方式、晶体的计算等知识点,侧重于学生的分析能力和计算能力的考查,这些知识点都是高考热点,注意价层电子对互斥理论确定原子杂化方式及分子空间构型、晶胞的计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | 在船底镶嵌锌块和将船体与电源负极相连,二者防腐的方法都称为牺牲阳极的阴极保护法 | |
| C. | 1 mol葡萄糖水解能生成2mol CH3CH2OH和2mol CO2 | |
| D. | 不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com