
下图表示 25℃时,向 1L,0.1mol·L-1的一元弱酸HA中加水稀释过程的变化图像,则图中纵坐标 y 表示的是

A.c(H+)或 c(OH-) B.HA的电离平衡常数Ka
C.c(H+)/c(HA) D.n(H+)或 n(OH-)
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列不正确的是( )
A.M与R的质子数之和一定等于19
B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期
D.M和R的质子数之差可能等于7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为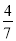 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:推断题
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:

试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
下列装置应用于实验室制备氯气并回收氯化锰的实验,能达到实验目的的是
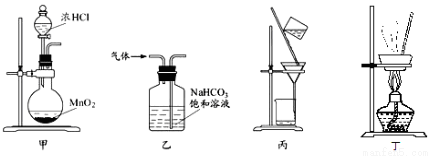
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O晶体
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:填空题
某同学所做的有关铜元素的实验流程如图:

(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2 对应的酸有两种,理论推测硫氰酸(H-S-C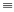 N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。
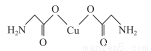
(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CO(g)的燃烧热:△H=-283.0KJ/ mol,则 2CO2(g ) =2CO(g)+O2(g)反应的△H= -55.0KJ/ mol
B.已知NaOH(aq) +HCl(aq )= NaCl(aq) +H2O(l) △H = -57.30KJ/ mol-1 ,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
C.已知2C(s)+2O2(g)=2CO2 (g) △H=a;2C(s)+O2 (g )=2CO(g) △H=b;则a>b
D.已知c(石墨,s)= C(金刚石,s) △H>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:简答题
【化学——选修化学与技术】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:____________。
(2)滤渣A的主要成分________;硅铝酸盐沉淀写成氧化物的形式是________。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 _。
(4)若该工厂用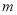 kg铝土矿共制得
kg铝土矿共制得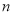 kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(5)若将铝溶解,下列试剂中最好选用_____ __(填编号)。
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂, Na3AlF6是配合物,其中内界是___,配位数为_ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com