
| 编号 | 实验目的 | 实验设计 |
| A | 除去NO2 中少量的NO | 向混合气体中通入O2 |
| B | 除去乙酸乙酯中的乙酸杂质 | 加入氢氧化钠溶液,分液 |
| C | 证明苯分子中不含碳碳双键 | 向苯中加入酸性高锰酸钾溶液 |
| D | 证明氯元素的非金属性比硅强 | 将HCl通入Na2SiO3溶液中 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol/L HF溶液pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、向反应后的溶液中继续加入100m L 0.1 mol/L Na2CO3有CaCO3沉淀产生 |
| D、该体系中有CaF2沉淀产生,且反应后溶液中的F-浓度为1×10-4.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液退色 |
| B、乙酸与乙醇可以发生酯化反应,又均可与氢氧化钠溶液反应 |
| C、糖类、油脂和蛋白质在一定条件下都能发生水解反应 |
| D、工业上通过石油分馏可以得到多种轻质液体燃料,通过煤的干馏可获得焦炭、煤焦油、焦炉气等多种化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
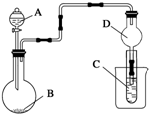
| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、实验仪器D可以起到防止溶液倒吸的作用 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液不变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 加热、加压 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com