
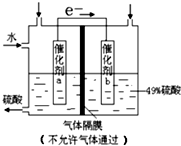
| A. | 该装置将化学能转化为电能,电流方向为b→a | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |
分析 A.该装置没有外加电源,是一个原电池,电流方向与电子流向相反;
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱;
C.催化剂a表面是SO2失去电子生成硫酸;
D.总方程为:SO2+H2O+$\frac{1}{2}$O2 =H2SO4,先设加入的SO2的量和加入的水的量,再根据方程求出生成硫酸的量和消耗的水的量.
解答 解:A.该装置没有外加电源,是一个原电池,把化学能转化为电能,电流方向与电子流向相反,所以电流方向为b→a,故A正确;
B.由图示可看出,电子由a表面转移到b表面,因此a表面发生氧化反应,由题意SO2转化为H2SO4发生氧化反应,因此催化剂a表面SO2发生氧化反应,催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程式为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:$\frac{1}{2}$O2+2H++2e-=H2O
总方程为:SO2+H2O+$\frac{1}{2}$O2=H2SO4
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:$\frac{xg×98g/mol}{64g/mol}$
水的质量变化为:y-$\frac{xg×98g/mol}{64g/mol}$
根据二者的比值为49%,可以求得$\frac{x}{y}$=$\frac{8}{15}$,故D正确;
故选B.
点评 本题以二氧化硫制硫酸为知识背景,考查了原电池的原理和电极方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 常温下,浓硝酸和浓硫酸不和铁、铝反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
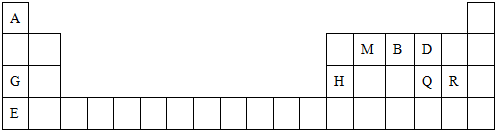
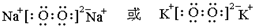 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
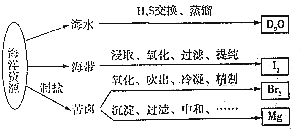
| A. | 从海水中提取D2O是化学变化 | |
| B. | 从海带中提取I2时可用乙醇进行萃取 | |
| C. | 实验室用带玻璃塞的棕色试剂瓶贮存液溴 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
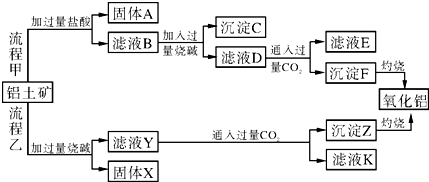
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com