
【题目】二氧化硅晶体是空间立体网状结构,如图所示:

关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】抗丙肝新药的中间体 合成路线图如下:
合成路线图如下:

已知:-Et为乙基。
(1)![]() 的名称是____,
的名称是____,![]() 所含官能团的名称是____。
所含官能团的名称是____。
(2) 的分子式为____。
的分子式为____。
(3)反应②化学方程式为________,反应③的反应类型是____。
(4)写出与 互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____
互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____
(5)设计由乙醇、1,3-丁二烯和甲氨( CH3NH2)合成![]() 路线(其他试剂任选)。__________
路线(其他试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用惰性电极电解MgCl2溶液:2Cl- + 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COO-+
CH3COO-+![]() +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O
C. 邻羟基苯甲酸中加入足量NaHCO3溶液:

D. 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热: CH3CHO +2Cu(OH)2+ OH-![]() CH3COO-+ Cu2O↓+3H2O
CH3COO-+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于工业、建筑业及食品加工业。某课外活动小组的同学拟制备亚硝酸钠、测定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。

①仪器M的名称是______________。
②装置A中用较浓的硫酸而不用稀硫酸的原因是_____________________。
③若装置B中生成等物质的量的NO与NO2,则装置B中发生反应的离子方程式为______。
④已知NO与NaOH溶液不反应,而NO2可与NaOH溶液发生反应:2NO2+2NaOH ![]() NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
(2)乙组同学拟测定甲组制得的产品中NaNO2的纯度。乙组同学采用高锰酸钾滴定法,称取m g试样于锥形瓶中,加入适量水溶解,然后用c mol·L-1的KMnO4溶液(适量稀H2SO4酸化)进行滴定,并重复上述操作2次。
①高锰酸钾溶液应盛放在___________(填“酸式”或“碱式”)滴定管中。
②滴定至终点时溶液的颜色变化是__________________。
③若滴定至终点时平均消耗VmL标准溶液,则产品的纯度为_____(用含c、m、V的代数式表示)。
(3)丙组同学拟设计实验证明:
①酸性条件下NaNO2具有氧化性。实验操作为________________________。
②HNO2的酸性比CH3COOH强。实验操作为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
I.探究KO2与水的反应
实验操作 | 现象 | 结论与解释 |
(1)取少量KO2固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 | 快速产生气泡,木条复燃 | 产生的气体是______ |
(2)一份滴加酚酞试液 | 先变红后褪色 | 可能的产物是______ |
(3)另一份滴加FeCl3溶液 | 观察到______ |
II. 探究KO2与SO2的反应

(4)正确的操作依次是___________________。
①打开K1通入N2 ,排尽装置内原气体后关闭
②拆卸装置至实验完成
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(5)A装置发生的化学方程式为____________________。
(6)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是_____。
(7)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,将沉淀过滤、洗涤、__,称重为2.33g。
②将N溶液移入_______(填仪器名称)中,用0.40mol/L酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出该实验总反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
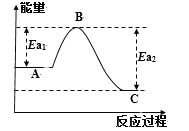
反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
反应③ 的ΔH3=_________kJ/mol。
CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率![]() ×100%):
×100%):

①由图可知生成CO和H2有相互/span>_______(填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) ![]() CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:

①图中判断反应到达平衡状态的依据是________________。
② 5min内H2的平均反应速率v(H2) =________mol/(Lmin)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______(填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,容积固定的密闭容中对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. 达到平衡时,容器内的压强不再变化
D. c1的取值范围为0 mol/L<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关事实,与水解反应无关的是
A. 热的纯碱溶液用于清洗油污
B. 氯化铁溶液腐蚀铜板
C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体
D. 用TiCl4和大量水反应,同时加热制备TiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com