
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 达到平衡时,B的转化率为80% | |
| C. | 相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| D. | 实验室中酒精燃烧,小面积着火,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
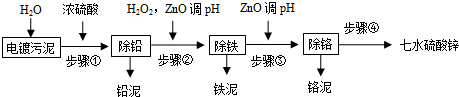
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
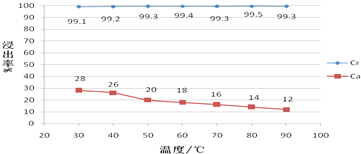
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com