
| A、HY水解方程式为:HY-+H2O?Y2-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(OH-)>c(Y2-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(Y2-)>c(H+) |
| D、H2Y 在电离时:H2Y+H2O?HY-+H3O+ |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、发烟硫酸的摩尔质量为178 |
| B、反应①中氧化剂与还原剂的物质的量之比为2:3 |
| C、反应②中氧化产物与还原产物的物质的量之比为1:3 |
| D、若反应②中消耗2 mol I2(SO4)3,则电子转移3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
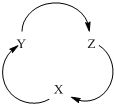 下列各物质中,不满足下图一步转化关系的选项是( )
下列各物质中,不满足下图一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na2O2 | NaOH | Na2CO3 |
| B | H2SO4 | SO2 | SO3 |
| C | H2SiO3 | SiO2 | Na2SiO3 |
| D | C2H5Br | CH2=CH2 | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、久置的氯水与新制的氯水,都能使有色布条褪色 |
| B、钠在空气中燃烧,发出淡蓝色的火焰,生成淡黄色固体 |
| C、硅能导电,可用作光导纤维 |
| D、玻璃花瓶和餐桌上的瓷盘都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应的反应速率一定大于吸热反应的反应速率 |
| B、熔融状态下能导电的化合物一定含离子键 |
| C、增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
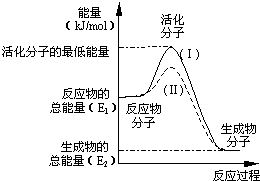 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | ||||
| B、Na2S溶液呈碱性:S2-+H2O?HS-+OH- | ||||
C、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
| ||||
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在K+、NH4+、CO32-、SO42-,一定不存在Ba2+、Cl- |
| B、一定存在NH4+、Cl-、CO32-、SO42-,可能存在K+ |
| C、c(SO42-)=0.2mol?L-1,c(NH4+)>c(SO42-) |
| D、如果溶液中存在NH4+、Cl-、CO32-、SO42-、K+五种离子,则c(K+)>0.2mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com