
| A. | 工业上利用铝热反应炼铁 | |
| B. | 将Mg、Al用导线连接并插入NaOH溶液中,判断Mg、Al金属性强弱 | |
| C. | 将CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀 | |
| D. | 实验室利用锌片和稀硫酸制H2时,为了加快制H2的反应速率可加入Cu(NO3)2 |
分析 A.Al与铁的氧化物发生铝热反应生成Fe,但工业上利用焦炭还原铁的氧化物;
B.Mg、Al用导线连接并插入NaOH溶液中,Al作负极;
C.SO2与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,而CO2不与Ba(NO3)2溶液反应;
D.加入Cu(NO3)2在酸性条件下具有强氧化性,与Zn反应不生成氢气.
解答 解:A.工业生产需要考虑经济价值,工业上利用焦炭还原铁的氧化物冶炼Fe,故A错误;
B.Mg、Al用导线连接并插入NaOH溶液中,Al作负极,但金属活泼性为Mg>Al,故B错误;
C.SO2与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,而CO2不与Ba(NO3)2溶液反应,则CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀,故C正确;
D.加入Cu(NO3)2在酸性条件下具有强氧化性,与Zn反应不生成氢气,可加适量硫酸铜加快生成氢气的速率,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2=2H2O+285.75KJ | B. | 2H2(g)+O2 (g)=2H2O(l)+571.5KJ | ||
| C. | H2(g)+O2(g)=H2O(g)+285.75KJ | D. | H2 (g)+O2(g)=H2O(l)-285.75KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
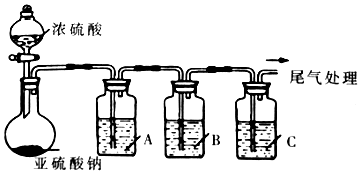
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:
某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,H2是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
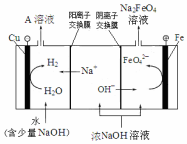 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3既是氧化剂又是还原剂 | B. | 氢元素既被氧化又被还原 | ||
| C. | 0.5mol氢气生成时转移1mol电子 | D. | 镁具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾”是微小水滴或冰晶组成的气溶胶系统 | |
| B. | “霾”中的灰尘对大气中的有害物质起吸附作用 | |
| C. | 雾霾中的二氧化硫、氮氧化物主要来自于化石燃料的燃烧 | |
| D. | 雾霾中的有机碳氢化合物主要来自于生物质的燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com