
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
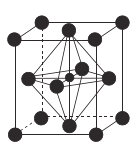
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
【答案】[Ar]3d54s2或1s22s22p63s23p63d54s2 Mn的3d能级半满,较稳定,不易失去电子 NCl3和HCN均为分子晶体,NCl3的相对分子质量较大,则熔沸点更高 ![]()
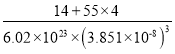
【解析】
(1)![]() 是25号元素,基态
是25号元素,基态![]() 原子的电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2,锰的第三电离能是失去3d轨道中的电子,又
原子的电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2,锰的第三电离能是失去3d轨道中的电子,又![]() 的3d轨道半满,稳定,不易失去电子,故电离能大于铁;
的3d轨道半满,稳定,不易失去电子,故电离能大于铁;
(2)NCl3和HCN均为分子晶体,NCl3的相对分子质量较大,分子间作用力更强,则NCl3的沸点更高;
(3)根据价层电子对互斥理论计算,NCl3的中心原子价层电子对数![]() ,
,![]() 的中心原子价层电子对数为
的中心原子价层电子对数为![]() ,
,![]() 的中心原子价层电子对数为
的中心原子价层电子对数为![]() ,故中心原子价层电子对数不同于其他微粒的是
,故中心原子价层电子对数不同于其他微粒的是![]() ;
;
(4)![]() (氮化锰)的晶胞结构可知,含1mol
(氮化锰)的晶胞结构可知,含1mol![]() ,晶胞参数为0.3851nm。该氮化锰的密度为:
,晶胞参数为0.3851nm。该氮化锰的密度为: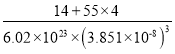
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图所示,下列说法正确的是
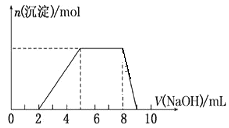
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B.原溶液中 Al3+与NH4+的物质的量之比为 1∶3
C.反应最后形成的溶液中的溶质含AlCl3
D.原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎等的治疗,回答下列问题:
(1)醋柳酯的分子式为_____________________。
(2)关于醋柳酯的说法中,正确的是_________
A.核磁共振氢谱中只有6个吸收峰 B.能发生取代、加成、氧化反应
C.1mol该物质最多可以和7molH2反应 D.分子中所有原子一定在同一平面内
(3)醋柳酯可由下图所示路线合成:

①A的结构简式为__________;中间产品C中混有反应物A和B,检验C中含有A的试剂是______________________。
②由C制醋柳酯的反应类型为____________________;写出C和足量NaOH溶液反应的化学方程式________。
③A的同分异构体很多,其中属于酯类、且能与FeCl3溶液反应显紫色的同分异构体有__种,写出一种的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是

A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要在干燥的氯化氢气流低温小火烘干
D.溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、④、⑤中均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸_____________(填“过量”、“适量”或“不足量”),理由是_________。
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是____。
(3)合金中Mg、Al的物质的量之比为_________________。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
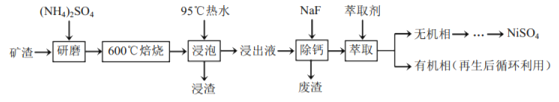
【题目】镍及其化合物用途广泛。某矿渣的主要成分是![]() (铁酸镍)、NiO、FeO、CaO、
(铁酸镍)、NiO、FeO、CaO、![]() 等,以下是从该矿渣中回收
等,以下是从该矿渣中回收![]() 的工艺路线:
的工艺路线:
已知:![]() 在350℃以上会分解生成
在350℃以上会分解生成![]() 和
和![]() 。
。![]() 在焙烧过程中生成
在焙烧过程中生成![]() 、
、![]() 。锡(Sn)位于第五周期第ⅣA族。
。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与![]() 混合研磨,混合研磨的目的是________。
混合研磨,混合研磨的目的是________。
(2)“浸泡”过程中![]() 生成
生成![]() 的离子方程式为________,“浸渣”的成分除
的离子方程式为________,“浸渣”的成分除![]() 、
、![]() 外还含有________(填化学式)。
外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入![]() 将
将![]() 还原为
还原为![]() ,所需
,所需![]() 的物质的量不少于
的物质的量不少于![]() 物质的量的________倍;除去过量的
物质的量的________倍;除去过量的![]() 后,再用酸性
后,再用酸性![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,还原产物为
,还原产物为![]() ,滴定时反应的离子方程式为________。
,滴定时反应的离子方程式为________。
(4)“浸出液”中![]() ,当除钙率达到99%时,溶液中
,当除钙率达到99%时,溶液中![]() ________
________![]() [已知
[已知![]() ]
]
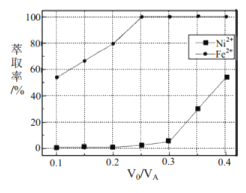
(5)本工艺中,萃取剂与溶液的体积比(![]() 对溶液中
对溶液中![]() 、
、![]() 的萃取率影响如图所示,
的萃取率影响如图所示,![]() 的最佳取值是________。
的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、F是C8H18裂解后的两种常见产物,二者互为同系物。A的产量可以用来衡量一个国家的石油化工发展水平,H是高分子化合物。由C8H18制备E、H的流程如下:

回答下列问题:
(1)C的结构简式为________________,D中官能团的名称为________________
(2)反应①的化学方程式为________________,所属反应类型为________________
(3)反应③的化学方程式为________________,实验室制备E使用饱和Na2CO3溶液的作用是________________
(4)检验F中官能团的试剂是__________,反应⑤的化学方程式为________________
(5)C8H18存在多种同分异构体,其中一氯代物只有1种的有机物的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳足量,反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加碳的量且表面积保持不变 ②将容器的体积缩小一半 ③保持体积不变,充入He,使体系压强增大 ④保持压强不变,充入He使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com