
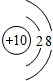 ,应位于第二周期0族,
,应位于第二周期0族, 应位于第三周期Ⅵ族,
应位于第三周期Ⅵ族, ,应位于第四周期ⅤⅡA族,
,应位于第四周期ⅤⅡA族,

 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 40 | 80 | 200 |
| 平衡常数K | 1 | 1.5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、x+y<z |
| C、C的体积分数提高 |
| D、在平衡的重新建立过程中,气体平均摩尔质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com