
【题目】下列实验操作、现象和结论均正确的是
操作 | 可能的实验现象 | 解释 | |
A | 用硫酸做催化剂的淀粉水解液中,加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 葡萄糖含醛基 |
B | 向酚酞溶液中加入足量Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将已氧化的Cu丝从酒精灯的外焰慢慢移向内焰 | 黑色的Cu丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:Na2CO3>NaHCO3 |
A.AB.BC.CD.D
【答案】CD
【解析】
A. 用硫酸做催化剂的淀粉水解液中,加入新制的Cu(OH)2悬浊液前,必须用NaOH中和,醛基才与Cu(OH)2反应生成红色沉淀,A错误;
B. Na2O2与水反应生成NaOH,溶液呈碱性,溶液变红,后褪色是因为Na2O2具有强氧化性,将溶液漂白,而不是生成的NaOH有漂白性,B错误;
C. CuO具有氧化性,乙醇有还原性和挥发性,两者发生反应:CH3CH2OH+CuO![]() Cu+CH3CHO+H2O,故黑色的Cu丝变红,C正确;
Cu+CH3CHO+H2O,故黑色的Cu丝变红,C正确;
D. 相同温度下,NaHCO3的溶解度小于Na2CO3的溶解度,反应中又消耗部分溶剂水,且生成的NaHCO3的质量大于Na2CO3的质量,故向饱和Na2CO3溶液中通入CO2有晶体析出,D正确;
答案选CD。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.

![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
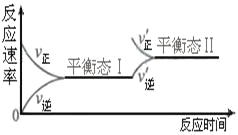
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说祛正确的是
A. 蛋白质是仅由碳、氢、氧、氯元素组成的一类高分子化合物
B. 可以用溴水鉴别![]() 和
和![]()
C. 用甲苯分别制取TNT、邻溴甲苯和苯甲酸所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
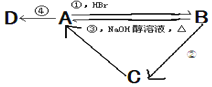
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的一组是( )
A. 甘油和乙醇互为同系物
B. CH2=CHCH2CH3 和 CH3CH=CHCH3 互为同分异构体
C.  是同一种物质
是同一种物质
D. O2 和 O3 互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
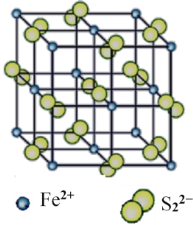
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为_____________,其中C原子的杂化形式是_________。
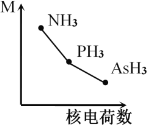
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是 ( )
A. NaOH的电子式:![]()
B. I4O9(碘酸碘)中碘的化合价为+1、+5
C. NH5的结构与NH4Cl相似,NH5的结构式为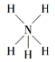
D. 离子结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com