
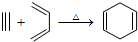 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2-甲基-1,3-丁二烯和2-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2,3-二甲基-1,3-丁二烯和1-丁炔 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>Cu2+>MnO2 | B. | MnO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>MnO2>Cl2 | D. | Cu2+>Fe3+>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
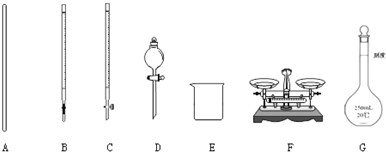
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
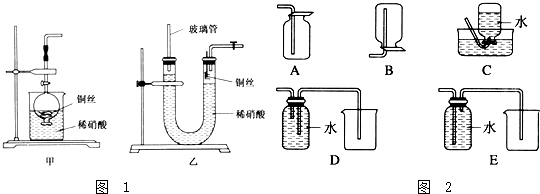
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2升的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数为4NA | |
| C. | 标准状况下,11.2升二氯甲烷所含分子数为0.5NA | |
| D. | 现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
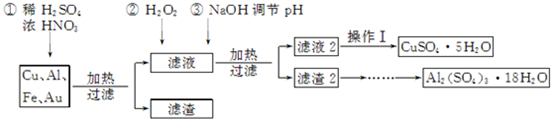
| 温度(K) | 失重(%) | |
| 第一阶段 | 323~523 | 40.54 |
| 第二阶段 | 553~687 | 48.65 |
| 第三阶段 | 1 043以上 | 84.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
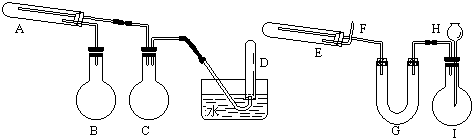
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com