
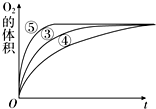
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
分析 (1)催化剂改变反应的途径,降低反应所需的活化能;
(2)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较,如催化剂或温度;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答 解:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,
故答案为:降低了反应的活化能;
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查影响化学反应速率的因素,较好的考查学生实验设计、数据处理、图象分析的综合能力,题目难度中等,注意信息的利用即可解答.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝合金的大量使用,归功于人们用电解法从氧化铝中获取铝 | |
| B. | 铜的活动性比铁弱,故在海轮外壳装铜块减缓海轮腐蚀 | |
| C. | 用电镀厂的废水中直接灌溉农田,可提高水的利用率 | |
| D. | 甲醛溶液具有杀菌消毒的能力,故能用甲醛溶液浸泡食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 34% | C. | 72% | D. | 17% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
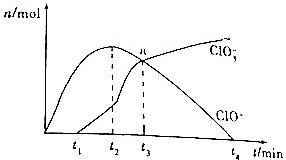 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )| A. | 参加反应所需要NaOH与氯气的物质的量之比一定为2:1 | |
| B. | a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 | |
| C. | t2~t4min,ClO-的物质的量下降的原因可能是3ClO-═2Cl-+ClO${\;}_{3}^{-}$ | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 除去乙醇中的微量水可加入金属钠,使其完全反应 | |
| C. | 乙酸乙酯中有乙酸杂质,可以加入氢氧化钠溶液,充分反应后静置分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com