
 (1)铁及铁的化合物在生产、生活中有着重要的用途.
(1)铁及铁的化合物在生产、生活中有着重要的用途.| n |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
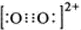 ,
,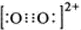 ;
;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
(16分)(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4) (3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为 。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
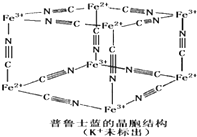
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一) :n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江哈九中高三上学期11月份月考化学试卷 题型:填空题
(16分)(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4)(3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为 。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一):n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省沈阳二中高一下学期期中考试化学试卷(带解析) 题型:填空题
(12分)(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com