
 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
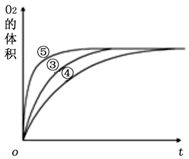
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
分析 Ⅰ、根据公式m=nM=cVM来计算氢氧化钾的质量,但是没有245mL的容量瓶;
Ⅱ、(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(3)根据金属的导热性很好,会导致热量的散失;
Ⅲ、(1)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答 解:Ⅰ、(1)没有230mL的容量瓶,所以用250mL的容量瓶,需要称量KOH固体m=nM=cVM=0.5mol/L×0.25L×56g/mol=7.0g;
故答案为:7.0;
Ⅱ、(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计;
故答案为:温度计;
(2)①3次温度差分别为:4.0℃,3.9℃,4.1℃,三组数据均有效,三次温度差平均值为4.0℃,
故答案为:4.0;
②50mL 0.50mol/LKOH溶液与30mL 0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5 kJ/mol;
故答案为:-53.50 kJ•mol-1;
(3)用环形铜丝搅拌棒代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,使测得的△H数值偏小;
故答案为:偏小;铜丝是热的良导体,导致热量散失;
Ⅲ、(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查热反应热的测定与计算,影响化学反应速率的因素,题目难度大,注意理解中和热的概念以及测定反应热的原理,明确常见化学实验的基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带 正电 |
| B | 将铜粉加入 1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活 泼 |
| C | 用坩埚钳夹住用砂纸 仔细打磨过的铝箔在 酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比 较低 |
| D | 向盛有少量浓硝酸、 稀硝酸的两支试管中 分别加入一片大小相 同的铜片 | 浓硝酸中铜片很快开始溶解,并放出 红棕色气体;稀硝酸中过一会铜片表 面才出现无色气体,气体遇空气变红 棕色 | 浓硝酸氧化性强 于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0008mol/L | B. | 0.00125mol/L | C. | 0.8mol/L | D. | 1.25mo/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
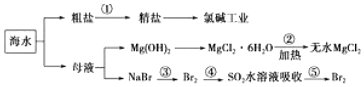
| A. | 工段②是风化过程 | |
| B. | 在工段③④⑤中溴元素均被氧化 | |
| C. | 工业上电解熔融状态下的氯化镁制取镁单质 | |
| D. | 工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
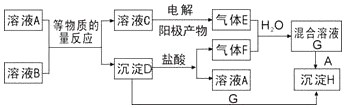
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入Ba(NO3)2溶液,再滴加稀盐酸,出现白色沉淀且不溶解,则原溶液中可能含有SO32- | |
| B. | 某气体使湿润的蓝色试纸变红,则该气体一定是酸性氧化物 | |
| C. | 乙醇中混有乙酸,加入氢氧化钠后蒸馏即得纯净的乙醇 | |
| D. | 在分液漏斗中加入溴水,然后加入适量CCl4,振荡后静置,溴可萃取到CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
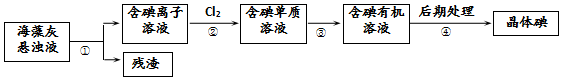
| A. | 步骤④的操作是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤①、③的操作分别是过滤、萃取 | |
| D. | 步骤③中加入的有机溶剂乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com