
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________。己知春季海水pH=8.1,预测夏季海水碱性将会_________(填写“增强”或“减弱”),理由是________(写出1条即可)
无机碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3仅为CO2的0.2% | ||
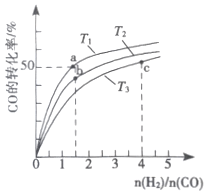
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
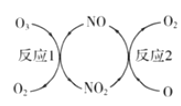
①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反应 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________。
(4)近年来,地下水中的氮污染己成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用 下,密闭容器中的H2可髙效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________。

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________。
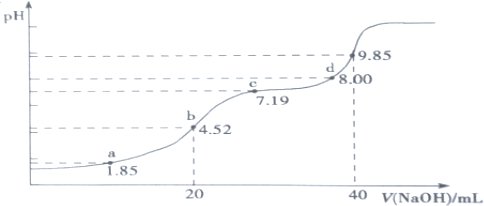
(6)大气污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3 的 pKa1=1.85, pKa2=7.19。该温度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________;c点所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)
【答案】HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱;一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol H2+N2O=N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量 O2+4e-+2N2O5=4NO3- c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
H2CO3平衡逆向移动,酸性减弱;一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol H2+N2O=N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量 O2+4e-+2N2O5=4NO3- c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
【解析】
(1)碳酸根离子、碳酸氢根离子水解,溶液呈碱性;夏天温度升高,水解反应为吸热反应,氢氧根离子浓度增大;升高温度后二氧化碳的溶解度减小,溶液酸性减弱等,导致溶液碱性增强;
(2)A.反应放热,其它条件相同时,温度越高,反应物的转化率越低;温度相同时,H2的转化率随n(H2)/n(CO)的增大而减小;
B.反应放热,n(H2)/n(CO)相同时,根据温度越高,反应物的转化率越低分析判断;
C.根据平衡常数k与浓度商Qc判断:K>Qc时,反应正向进行;K=Qc时,反应达到平衡状态;K<Qc时,反应逆向进行;
D.反应正向是体积减小的反应,增大气体压强,反应正向进行,反应物的含量减小;
(3)①反应过程如图1是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气;
②Ⅰ.O3(g)+O(g)═2O2(g)△H=-143kJ/mol,Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=-200.2kJ/mol,盖斯定律计算Ⅰ-Ⅱ得到反应2的热化学方程式;
(4)①由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根;
(5)甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,石墨Ⅱ为正极;
(6)b点恰好反应生成NaHSO3,溶液显酸性,则c(H+)>c(OH-),说明HSO3-的电离程度对应其水解程度,结合电荷守恒分析离子浓度大小;c点pH=7.19=pKa2,结合Ka2=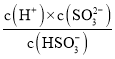 可知:c(HSO32-)=c(SO32-),据此结合电荷守恒分析。
可知:c(HSO32-)=c(SO32-),据此结合电荷守恒分析。
(1)由于存在水解平衡:CO32-+H2O![]() HCO3-+OH-或HCO3-+H2O
HCO3-+OH-或HCO3-+H2O![]() H2CO3+OH-,所以海水呈弱碱性;一方面水解平衡为吸热反应,夏天温度升高,水解平衡向着正向移动,c(OH-)增大,溶液碱性增强;另外夏天光合作用强,c(CO2)减小,使平衡CO2+H2OH2CO3逆向移动,溶液酸性减弱;还有夏天温度升高,二氧化碳在水中溶解度减小,酸性减弱,导致碱性增强;
H2CO3+OH-,所以海水呈弱碱性;一方面水解平衡为吸热反应,夏天温度升高,水解平衡向着正向移动,c(OH-)增大,溶液碱性增强;另外夏天光合作用强,c(CO2)减小,使平衡CO2+H2OH2CO3逆向移动,溶液酸性减弱;还有夏天温度升高,二氧化碳在水中溶解度减小,酸性减弱,导致碱性增强;
(2)A.由图可知,当n(H2)/n(CO)=1.5时,a点CO的转化率大于温度为T3时对应CO的转化率,当温度为T3时,随着n(H2)/n(CO)增大,CO的转化率增大,H2的转化率减小,所以有a>b>c,故A错误;
B.根据CO(g)+2H2(g)CH3OH(g)△H<0,因为是放热反应,所以温度越高CO的转化率越小,由图可以看出,当n(H2)/n(CO)相等时,T1、T2、T3温度下对应CO的转化率:T1>T2>T3,所以温度大小为:T3>T2>T1,故B错误;
C.a点时,CO的转化率为50%,反应的三段式为:
CO(g)+2H2(g)CH3OH(g)
起始量(mol/L)1 1.5 0
变化量(mol/L)0.5 1 0.5
平衡量(mol/L)0.5 0.5 0.5
平衡常数K=![]() =4,再通入0.5mol CO和0.5molCH3OH,c(CO)=c(CH3OH)=1mol/L,c(H2)=0.5mol/L,浓度商Qc=
=4,再通入0.5mol CO和0.5molCH3OH,c(CO)=c(CH3OH)=1mol/L,c(H2)=0.5mol/L,浓度商Qc=![]() =4=K,所以平衡不移动,故C正确;
=4=K,所以平衡不移动,故C正确;
D.c点状态下再通入1molCO和4mol H2,在等温等容的条件下,投料比不变,相当于加压,平衡向正反应方向移动,新平衡H2的体积分数减小,故D错误;
故答案为C;
(3)①反应过程如图1是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气,反应过程中NO参与反应最后又生成,作用是催化剂;
②已知:②Ⅰ.O3(g)+O(g)═2O2(g)△H=-143kJ/mol,Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=-200.2kJ/mol,根据盖斯定律,Ⅰ-Ⅱ得:NO2(g)+O(g)═NO(g)+O2(g)△H2=(-143kJ/mol)-(-200.2kJ/mol)=+57.2 kJ/mol,故反应2的热化学方程式为NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2 kJ/mol;
(4)①由原理的示意图可知,Ir的表面发生反应:H2+N2O=N2+H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根,不利于降低溶液中的含氮量;
(5)甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,电极反应式为NO2+NO3--e-=N2O5,石墨Ⅱ为正极O2+2N2O5+4e-═4NO3-;
(6)b点是用0.1molL-1NaOH溶液20mL滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,则c(H+)>c(OH-),说明HSO3-的电离程度对应其水解程度,c(Na+)>c(HSO3-),由于氢离子还来自水的电离,则c(H+)>c(SO32-),溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);c点pH=7.19=pKa2,结合Ka2=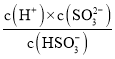 可知:c(HSO32-)=c(SO32-),根据电荷守恒c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-)可知:c(H+)+c(Na+)=3c(HSO3-)+c(OH-),此时溶液呈碱性,则c(H+)<c(OH-),所以c(Na+)>3c(HSO3-)。
可知:c(HSO32-)=c(SO32-),根据电荷守恒c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-)可知:c(H+)+c(Na+)=3c(HSO3-)+c(OH-),此时溶液呈碱性,则c(H+)<c(OH-),所以c(Na+)>3c(HSO3-)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。
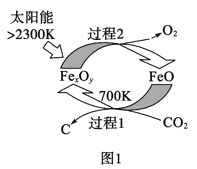
(1)图1是由CO2制取C的太阳能工艺。已知过程1发生的反应中![]() =6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
=6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
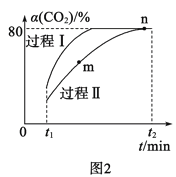
(2)利用CO2合成甲醇的反应为:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如图3所示。
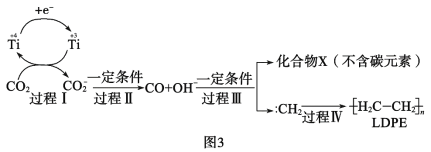
①过程Ⅰ~Ⅲ中碳元素发生__反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+___+___=![]() +___。__
+___。__
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氨水中通入过量的SO2:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
B.大理石与醋酸反应:CaCO3+2H+ =Ca2+ + H2O + CO2↑
C.向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D.碳酸氢钠溶液和过量氢氧化钡溶液混合:2HCO3-+ Ba2+ + 2OH-== BaCO3↓+ CO32- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,3.2gO2中氧分子数为0.1NA
B.标准状况下,22.4L正己烷中碳原子数为6NA
C.78gNa2O2在足量CO2中充分反应转移的电子数约为2NA
D.密闭容器中,3molH2和1molN2充分反应后氨分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为铁棒,N为石墨棒。关于此装置的下列叙述中,不正确的是( )
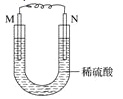
A.M为负极,N为正极
B.N上发生的反应为2H++2e=H2↑
C.M上发生的反应为Fe-3e-=Fe3+
D.溶液中的硫酸根离子向M移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
n(A) | n(B) | n(D) | n(D) | |||
甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1
B.a=2.2
C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%
D.K1=K2>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(ZnS)=1.6×10-24;pM=-lgc(M2+)(M2+为Cu2+或Zn2+)。常温下,向10mL0.10mol·L-1CuCl2溶液中滴加0.10mol·L-1Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是

A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向上移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
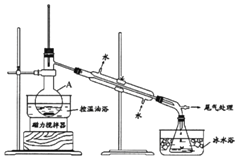
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1-氯丁烷制取少量的1,2-丁二醇时,需要经过下列哪几步反应
A. 加成→消去→取代B. 消去→加成→水解
C. 取代→消去→加成D. 消去→加成→消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com