
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |


科目:高中化学 来源: 题型:
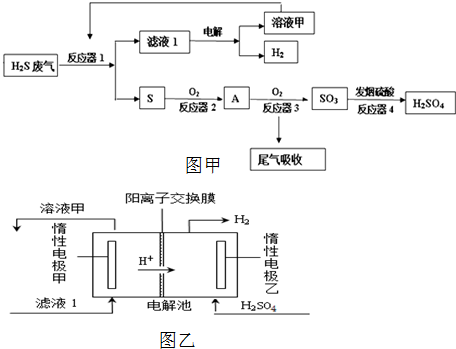
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率(×10-3mol.min-1 | 7.34 | 3.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH |
| B、25℃时,水电离出来的c(H+)均为 10-11mol/L的两种酸,酸的浓度:HCN>CH3COOH |
| C、25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN |
| D、25℃时,pH均为3的CH3COOH与HCN溶液各100ml与等浓度的NaOH溶液反应,消耗NaOH溶液体积:CH3COOH>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -定条件下,在绝热恒容2L密闭容器中进行反应N2(g)+3H2(g)?2NH3(g)△H<0,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )
-定条件下,在绝热恒容2L密闭容器中进行反应N2(g)+3H2(g)?2NH3(g)△H<0,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )| A、若在t2时刻再充入一定量He,达平衡时c(H2)<0.4mol/L |
| B、a点表示NH3生成速率与NH3分解速率相等 |
| C、b点和c点H2的转化率相等 |
| D、若在t2时刻再充入一定量He,达平衡时化学平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)可作为洁净的液体化石燃料,以CO和H2为原料生产二甲醚的一种工艺主要发生以下三个反应:
二甲醚(CH3OCH3)可作为洁净的液体化石燃料,以CO和H2为原料生产二甲醚的一种工艺主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1 | K1 |
| ② | 2CH3OH(g)?CH2OCH3(g)+H2O(g)△H1=-24kJ?mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-4kJ?mol-1 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响 |
| B、淀粉、油脂、蛋白质都能在人体内水解,也能在体内氧化提供能量 |
| C、CO2与SiO2都是ⅣA族元素的氧化物,但它们的物理性质特别是在熔沸点、硬度上相差很大,这是由于它们的化学键类型不同造成的 |
| D、酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:NH3>PH3>AsH3 |
| B、结合质子的能力:OH->CH3COO->Cl- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种非极性分子 |
| B、它还能以配位键跟Cl-结合 |
| C、它的沸点比PCl3更高 |
| D、已知NBr3对光很敏感,故NCl3也具有光敏性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com