
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�����Y�ǵ��ʡ�
SO 2��g�� + 2CO��g��![]() 2X��g��+Y��l��
2X��g��+Y��l��
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶����ó��������崫������ò�ͬʱ���SO2��COŨ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c��SO2��/mol��L-1 | 1.00 | 0.50 | 0.23 | 3.00��10-37 | 3.00��10-37 |
c��CO��/mol��L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
����˵������ȷ����
A. X�Ļ�ѧʽΪCO2
B. ǰ1s��v��X��=" 1.00" mol��L-1��s-1
C. �û���ԭ��������SO2�Ļ�ԭ��
D. ���¶��£��˷�Ӧ��ƽ�ⳣ������ֵ��3.33��1036
���𰸡�C
��������
����A���÷�Ӧ�ǽ�����Ļ��գ�����Y������S���ʣ����������غ㶨�ɣ���X�Ļ�ѧʽ��CO2����ȷ��B��ǰ1s�ڣ�CO�����ʵ���Ũ�ȼ�С1.00mol/L����X�����ʵ���Ũ������1.00mol/L������v��X��=" 1.00" mol��L-1��s-1����ȷ��C���ڸ÷�Ӧ�У�SԪ�صĻ��ϼ۽��ͣ��������������������˶�������������ԣ�����D��3sʱ���÷�Ӧ�ﵽƽ��״̬��CO�����ʵ���Ũ�ȼ���2.00mol/L����X��Ũ������2.00mol/L�����Ը÷�Ӧ��ƽ�ⳣ��K=2.002/[2.002����3.00��10-37��]= 3.33��1036����ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʳƷ��ҵ����������ķ�ɫ������һ���ĵ������ԣ��������Ʊ�¶�ڿ����л���������Ӧ���������ƣ�һ��ģ�ҵ�ô�����Һ���յ��������Ʊ�NaNO2��ʵ��װ�����£�

��֪��NO2+NO+2NaOH=2NaNO2+H2O��2NO2+2NaOH=NaNO2+NaNO3+H2O
�ش��������⣺
(1)������ӦʱNO��NO2�����ʵ���֮��Ϊ1��1ʱ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________��
(2)װ��B��������____________________��װ��C��ͨ��O2��Ŀ����_______________��
(3)��Ӧ��A����Һ������Ũ�����ᾧ������õ���Ʒ��
��ͬѧȡ�����IJ�Ʒ����ˮ����ϡ�����ữ����ʪ���KI������ֽ���飬��ֽ�������ó���ƷΪNaNO2����ͬѧ��Ϊ���۲��ɿ�����������____________________________��
(4)����V LijNaOH��Һ����ȫ����n mol NO2�� m mol NO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ______________ mol/L��
����������Һ��c(NO3-)��c(NO2-)=1��9����ԭ���������NO2��NO�����ʵ���֮��n��m=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦΪH+(aq)+OH(aq)![]() H2O(l) ��H=57.3 kJ/mol��ϡ���ᡢŨ���ᡢϡ����ֱ���0.1 mol��L1��NaOH��Һǡ����ȫ��Ӧ���ų�������������NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ(CH3COOH����Ҫ����)��������������ȷ����
H2O(l) ��H=57.3 kJ/mol��ϡ���ᡢŨ���ᡢϡ����ֱ���0.1 mol��L1��NaOH��Һǡ����ȫ��Ӧ���ų�������������NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ(CH3COOH����Ҫ����)��������������ȷ����
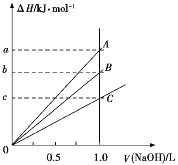
A��A��ʾϡ������NaOH��Һ�ķ�Ӧ
B��B��ʾϡ������NaOH��Һ�ķ�Ӧ
C��b=5.73
D��C��ʾŨ������NaOH��Һ�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ҫ�Ļ�ԭ������֪���з�Ӧ���Ȼ�ѧ����ʽ�����й��ڷ�Ӧ���ʱ��ж���ȷ����
2H2(g)+O2(g)===2H2O(g) ��H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) ��H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) ��H3
2Al(s)+3/2O2(g)===Al2O3(s) ��H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) ��H5
A. ��H1<0����H3>0 B. ��H5<0����H4<��H3
C. ��H1=��H2+��H3 D. ��H3=��H4+��H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ũ����ͬ����ˮ��Cl2��CCl4��Һ�������ʵ�顣�����й�ʵ���˵���У�����ȷ����
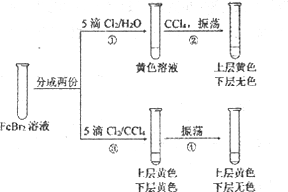
A. �������з����ķ�Ӧ��Br2+ 2Fe2+��2Br��+2Fe3+
B. �����ںͲ�����֮���Թ��ϲ���Һ�ijɷ���ͬ
C. �����ٺ����Һ��û��Br2������Ӧ�����п�����Br2����
D. ʵ��˵����CCl4Ӱ����Cl2��Br2��Fe3+�����Ե�ǿ��˳��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ַdz���Ҫ�Ľ���Ԫ�أ��ںܶ��������Ź㷺��Ӧ�á����÷���м��ԭ������Ʒλ���̿��Ʊ������̣�Ȼ����е�⣬���Ʊ������̵��¹��գ������̼�ͼ���£�
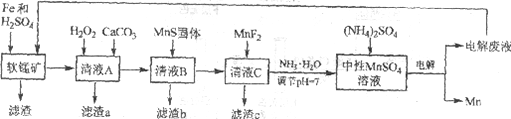
��֪��
i. ��Ʒλ���̿���Ҫ�ɷ���MnO2��Al2O3��Fe2O3��Cu2(OH)2CO3��CaCO3��SiO2�ȡ�
ii. ���ֽ��������������������ʱ��pH
Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | |
��ʼ������pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
������ȫ��pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii. ���ֻ�������ܽ��Ի��ܶȻ�(Ksp)
MnF2 | CaS | MnS | FeS | CuS |
����ˮ | ����ˮ | 2.5��10��13 | 6.3��10��18 | 6.3��10��36 |
(1)�о�����������Fe��Fe2+�����Ի�ԭMnO2����������ڵ������£�MnO2��Fe����Ϊspan>Fe3+�����ӷ���ʽ��____________��
(2)��ҺA����H2O2������Ȼ�����CaCO3����Ӧ����Һ��pH��5������a����Ҫ�ɷ����л������NH4Fe3(SO4)2(OH)6��
��H2O2��������____________(�����ӷ���ʽ��ʾ)��
������a�г��˻����������Ҫ�ɷֻ���X����ƽ���ƶ�ԭ�����Ͳ���x��ԭ��____________��
(3)�����ӷ���ʽ��ʾMnS��������ã�____________��
(4)����c�ijɷ���____________��
(5)����ͼ��ʾװ�ã��ö��Ե缫�������MnSO4��Һ�����Ƶý���Mn��������Ӧ�У�
i. Mn2++2e����Mn ii. 2H++2e����H2��
�缫��H2�IJ�������������ǿ��ѣ�Ӱ���Ʒ������
�ٵ��������ĵ缫����ʽ��________________��
����ҺC��Ҫ�ð�ˮ����pH��7��ԭ����____________��
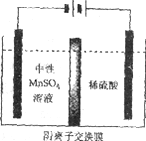
�۵��ʱ������MnSO4��Һ�м���(NH4)2SO4�����ó���������Һ������֮�⣬����___________(��ϵ缫��Ӧʽ�����ӷ���ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧ�е������仯����Ҫ���塣�����ѧ����֪ʶ�ش��������⣺
��1����֪һ����̼��ˮ������Ӧ���̵������仯��ͼ��ʾ��
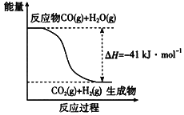
��Ӧ���Ȼ�ѧ����ʽΪ____________________________________________��
��2����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γ�(���)1mol��ѧ��ʱ�ͷ�(������)����������֪��N��N���ļ�����948.9kJ��mol��1��H��H���ļ�����436.0kJ��mol��1��N��H���ļ�����391.55kJ��mol��1����![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ��H=______________��
NH3(g) ��H=______________��
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪����C(s��ʯī)+O2(g)![]() CO2(g) ��H1=��393.5kJ��mol��1
CO2(g) ��H1=��393.5kJ��mol��1
��2H2(g)+O2(g)![]() 2H2O(l) ��H2=��571.6kJ��mol��1
2H2O(l) ��H2=��571.6kJ��mol��1
��2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ��H3=��2599kJ��mol��1
4CO2(g)+2H2O(l) ��H3=��2599kJ��mol��1
298Kʱ��Ӧ2C(s��ʯī)+H2(g)![]() C2H2(g)���ʱ䣺��H=_______________��
C2H2(g)���ʱ䣺��H=_______________��
��4����֪�����ȷ�Ӧ�Ƿ��ȷ�Ӧ����֪�������£�
4Al(s)+3O2(g)![]() 2Al2O3(s) ��H1
2Al2O3(s) ��H1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ��H2
2Fe2O3(s) ��H2
������ڦ�H1����H2�ıȽ���ȷ����________
A.��H1>��H2 B����H1<��H2 C����H1=��H2 D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ���ʵ�˵����ȷ����(����)
A. ��ѧ��Ӧ���ʿ���ijʱ������������ʵ�������ʾ
B. ��ͬһ��Ӧ�У��÷�Ӧ���������Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ���ʵ�ֵ����ȵ�
C. ��ѧ��Ӧ������ָ��Ӧ���е�ʱ���ڣ���Ӧ��Ũ�ȵļ��ٻ�������Ũ�ȵ�����
D. ���õ�λʱ�������������ʵ���Ũ�ȵı仯����ʾ��������������ķ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ�þ��Һ���ܶ�Ϊ1.2 g��mL-1������þ���ӵ���������Ϊ5.0%��300 mL����Һ��Cl-�����ʵ���ԼΪ(����)
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com