
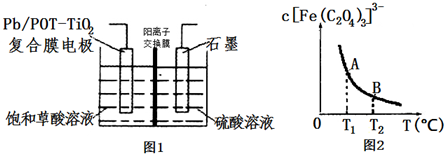
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)①反应速率v(CO2)=$\frac{△c}{△t}$;
②在不改变反应混合物用量的前提下,为了提高CH4气体的转化率,可使平衡右移;
(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为H2C2O4+2H++2e-=H2C2O3+H2O;
(4)从图2所示知温度升高溶液中[Fe(C2O4)3]3-的浓度减小,平衡右移;
草酸是一种温和的还原剂,加入少量KMnO4固体,草酸被氧化,浓度减小,平衡右移.
解答 解:(1)反应H2C2O4 (s)?H2O(g)+CO(g)+CO2(g)△H=+340kJ•mol-1的平衡常数表达式 K=c(H2O)•c(CO)•c(CO2);
密闭容器中,保持温度不变,
A.反应H2C2O4 (s)?H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;
B.反应H2C2O4 (s)?H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态,故B正确;
C.气体摩尔体积只与气体状态有关,当气体摩尔体积不再发生变化,不能说明该反应已达到化学平衡状态,故C错误;
D.生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,顾D错误,
故答案为:c(H2O)•c(CO)•c(CO2);AB;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>O.
起始(mol)4 6 0 0
变化(mol)0.1×1 0.1×1 0.1×2 0.1×2
平衡(mol)3.9 5.9 0.1×2 0.1×2
①平衡时,该反应的平均反应速率v(CO2)=$\frac{△c}{△t}$=$\frac{\frac{0.1×1}{2}}{5}$=0.01mol•L-1min-1,
故答案为:0.01;
②反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>O正反应为吸热反应,且是一个气体体积增大的反应,故升高温度或增大容器的体积(减小压强)平衡右移,CH4气体的转化率升高,
故答案为:升高温度或增大容器的体积(减小压强);
(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为H2C2O4+2H++2e-=H2C2O3+H2O,
故答案为:H2C2O4+2H++2e-=H2C2O3+H2O;
(4)从图2所示知温度升高溶液中[Fe(C2O4)3]3-的浓度减小,[Fe(C2O4)3]3-?Fe3++3C2O42-平衡右移,则A点的c(Fe3+)<B点的c(Fe3+).
草酸是一种温和的还原剂,加入少量KMnO4固体,草酸被氧化,浓度减小,平衡右移,Fe3+的浓度增大.
故答案为:<;增大.
点评 本题考查平衡状态的判断、电化学、反应速率、平衡影响因素,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质.


科目:高中化学 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1 mol H2的能量比2 mol H的能量低 | |
| C. | 1 mol H2离解成2 mol H要放出437.6 kJ热量 | |
| D. | 氢原子不如氢分子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | 现象 | 装置 | |
| A | 氯水 | 石蕊 | 溶液先变红后褪色 | 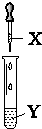 |
| B | 氨水 | AgNO3溶液 | 先产生沉淀后逐渐溶解 | |
| C | NaOH溶液 | AlCl3溶液 | 产生白色沉淀且不消失 | |
| D | 双氧水 | 酸性淀粉KI溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
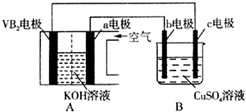 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )| A. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ | |
| C. | 电池内部OH-移向a电极,溶液pH减小 | |
| D. | 忽略溶液体积变化,电解后B装置中溶液的pH为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com