
 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHC03固体受热分解 | 澄済石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| A. | 答案A | B. | 答案B | C. | 答案C | D. | 答案D |
分析 A.试管中空气也能使肥皂水冒泡;
B.氯化铵和氢氧化钙混合加热生成氨气,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈红色;
C.二氧化碳能使澄清石灰水变浑浊;
D.不饱和烃能使溴的四氯化碳褪色.
解答 解:A.加热过程中的热空气、铁和水蒸气反应生成的氢气都能使肥皂水冒泡,所以肥皂水冒泡该反应不一定发生,故A错误;
B.NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CaCl2+H2O、NH3+H2O?NH3•H2O?NH4++OH-,氨水溶液呈碱性,所以能使酚酞试液变红色,故B正确;
C.2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,二氧化碳能使澄清石灰水变浑浊,如果②中澄清石灰水变浑浊,则①中一定发生反应,故C正确;
D.溴的四氯化碳褪色说明有不饱和烃生成,所以①中一定发生化学反应,故D正确;
故选A.
点评 本题考查实验装置的综合,为高频考点,把握发生的反应、反应与现象的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④①②③ | C. | ②①③④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
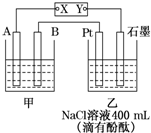 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
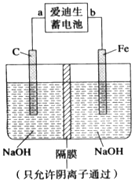 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应不必加热就能发生 | |
| B. | 化学反应一定有能量变化 | |
| C. | 吸热反应发生过程中必须加热 | |
| D. | 化学反应热效应数值与反应物的多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 最外层有5个电子的原子不一定是非金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①③⑤ | C. | ①②③⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com