
| A. | K2S | B. | MgF2 | C. | MgS | D. | NaF |
分析 元素最高正价与负价的绝对值之差为4,根据最高正价+|最低负价|=8,可知该元素最高正价为+6,形成离子应为S元素,硫离子核外有18个电子,所以另一离子应含有18个电子,以此解答该题.
解答 解:元素最高正价与最低负价的绝对值之差是4,
令该元素最高正价为x,根据最高正价+|最低负价|=8,则:
x-(8-x)=4,解得x=6
即该元素最高正价为+6,形成离子应为S元素,硫离子核外有18个电子,该元素的离子与另外离子核外电子排布相同的离子,则另一离子应含有18个电子,为阳离子.故A符合.
故选A.
点评 本题考查元素的推断与物质的组成,为高频考点,侧重考查学生的分析能力,推出元素为S元素是解答本题的关键,学生应学会利用原子结构来推断元素.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
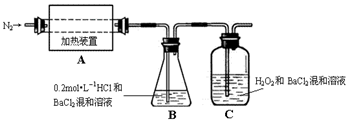
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是177 | B. | 中子数是117 | C. | 核外电子数117 | D. | 质子数是177 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
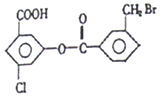 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳链是直链的烃,其含氢量是碳原子数相同的烃中最大的 | |
| B. | 相对分子质量越大的烷烃,其密度可能越大 | |
| C. | 有机物在空气中充分燃烧,各元素的最终产物分别是C→CO2,H→H2O | |
| D. | 在控制反应物和产物均为气态的条件下,分子中氢原子数为4的烃,燃烧反应前后体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL4mol•L-1盐酸与8.7gMnO2共热能制取氯气0.1NA | |
| B. | 6.0gSiO2晶体中含有的硅氧键数目为0.4NA | |
| C. | 300mL2mol•L-1酒精水溶液中所含分子数为0.6NA | |
| D. | 标准状况下,22.4L氯气参与反应时转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备乙炔时,为减慢反应速率,可用饱和食盐水代替水 | |
| B. | 可以用NaOH溶液除去苯中的溴杂质 | |
| C. | 用KMnO4酸性溶液可以除去乙烯中混有的乙炔 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com