
科目:高中化学 来源:2017届广东省潮州市高三8月月考理综化学试卷(解析版) 题型:填空题
(1)2 mol CO(NH2)2中含________mol C,________ mol N,________ mol H,所含氧原子跟________gH2O所含氧原子个数相等。
(2)①标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl所含H原子个数由多到少的顺序是______________________。
(3)2.3 g Na中含________mol e-,在跟足量水反应中产生标准状况下的H2______L。
(4)含0.4 mol Al2(SO4)3的溶液中,含________mol SO,Al3+物质的量________0.8 mol(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
(2016·绍兴一中质量诊断)甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各向其中加入1 mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
查看答案和解析>>
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-===5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显血红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显血红色,该红色物质是______(用化学式表示);CCl4中显紫红色的物质是______(用电子式表示)。
②第二份试剂中加入足量KI固体后,反应的离子方程式为__________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:__________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?____(填“是”或“否”),并说明理由:_________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是
________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:选择题
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ②⑤ B. ②③⑥ C. ①⑤⑥ D. ③⑥
查看答案和解析>>
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省漳州市高一(下)期中化学试卷(解析版) 题型:填空题
下列各组中:
①金刚石②12C③液氯④14C⑤CH3CH2CH2CH3⑥氯水⑦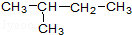 ⑧
⑧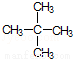 ⑨C60
⑨C60
属于同素异形体的是 (用序号回答,下同),属于同分异构体的是 属于同位素的是 .
查看答案和解析>>
科目:高中化学 来源:2017届陕西省安康市高三上学期第一次月考化学试卷(解析版) 题型:实验题
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
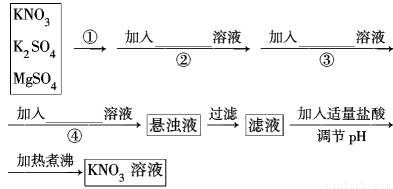
(1)操作①为_________________________。
(2)操作②~④加入的试剂依次可以为:______________________________
(3)如何判断SO42-已除尽? _
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,其理由是______________
(5)该同学的实验设计方案是否严密?请说明理由:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期暑假联考化学试卷(解析版) 题型:填空题
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为: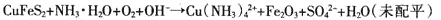
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。
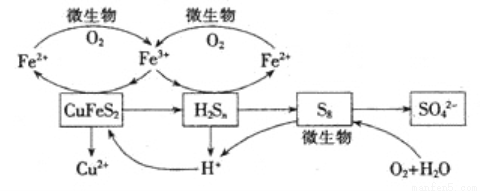
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com