
【题目】锂离子电池又称为“摇摆电池”,广泛使用于电动自行车等,其充放电过程就是锂离子的嵌入和脱嵌过程(习惯上正极用嵌入或脱嵌表示,负极用插入或脱插表示),即充放电过程就是锂离子在正、负极间往返运动而形成电流。其装置结构简图如图所示(电解液为溶有LiPF6的碳酸酯类溶剂,隔膜为仅有锂离子能通过的高分子膜),工作原理为C6Li+Li(1-x)MO2![]() LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
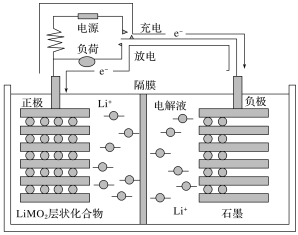
A.电池放电时,正极为石墨
B.锂离子电池的优点是质量小,电容量大,可重复多次使用
C.电池充电时阳极的反应为LiMO2-xe-=Li(1-x)MO2+xLi+
D.锂离子电池的电解液不能是水溶液,因为锂是活泼金属,能与水反应
科目:高中化学 来源: 题型:
【题目】下列有关常见有机物说法正确的是![]()
A.糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物
B.除去乙醇中少量的乙酸:加入足量生石灰,蒸馏
C.乙醇和苯都不能使溴的四氯化碳溶液和酸性![]() 溶液褪色
溶液褪色
D.石油裂化的主要产品是甲烷、乙烯和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
![]() 时溶解度
时溶解度![]() 克
克![]() 克水
克水![]() ,
,![]() :111,
:111,![]() :
:![]()

![]() 稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
A ![]() 酒精
酒精 ![]() 双氧水
双氧水 ![]() 苯酚
苯酚 ![]() “84”消毒液
“84”消毒液![]() 溶液
溶液![]()
![]() 操作Ⅰ的名称是____;操作Ⅱ是根据
操作Ⅰ的名称是____;操作Ⅱ是根据![]() 和
和![]() 两物质在____
两物质在____![]() 填性质
填性质![]() 上差异,采用____
上差异,采用____![]() 填操作步骤
填操作步骤![]() 、趁热过滤得到
、趁热过滤得到![]() 粗晶体的。
粗晶体的。
![]() 上述流程中可以循环使用的物质有石灰、
上述流程中可以循环使用的物质有石灰、![]() 、____和____
、____和____![]() 写化学式
写化学式![]() 。
。
![]() 向
向![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() ,该反应中的还原剂是_________。
,该反应中的还原剂是_________。
![]() 铋酸钠
铋酸钠![]() ,不溶于水
,不溶于水![]() 用于定性检验酸性溶液中
用于定性检验酸性溶液中![]() 的存在
的存在![]() 铋元素的还原产物为
铋元素的还原产物为![]() ,Mn的氧化产物为
,Mn的氧化产物为![]() 价
价![]() ,写出反应的离子方程式_________。
,写出反应的离子方程式_________。
![]() 写出
写出![]() 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
![]() 若不考虑物质循环与制备过程中的损失,则
若不考虑物质循环与制备过程中的损失,则![]() 可制得____
可制得____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑![]() 在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从锑的硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从锑的硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:![]()
关于反应![]() 和
和![]() 的说法错误的是
的说法错误的是![]()
A.反应![]() 中每1mol
中每1mol![]() 参加反应时,共转移6mol电子
参加反应时,共转移6mol电子
B.反应![]() 中的氧化剂是
中的氧化剂是![]() 和
和![]() ,
,![]() 中的氧化剂是
中的氧化剂是![]()
C.反应![]() 说明高温下C的还原性比Sb强
说明高温下C的还原性比Sb强
D.每生成4molSb时,反应![]() 与反应
与反应![]() 中还原剂的物质的量之比为1:1
中还原剂的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
A.A和B的转化率均是20%B.x = 3
C.平衡时A的物质的量为2.8molD.平衡时气体压强比原来减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)![]() 2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是

A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
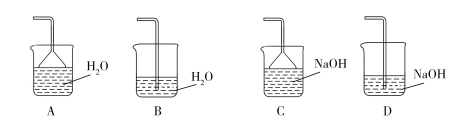
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:
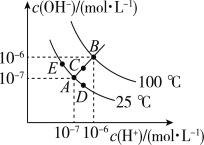
(1)图中ABCDE五点的KW间的大小关系是___________.(用ABCDE表示)
(2)若从A点到D点,可采用的措施是______.
a.升温
b.加入少量的盐酸
c.加入少量的NaOH固体
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈____(酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组都为两种化合物溶于水时电离出的离子:①Na+、OH-、![]() ,②H+、Cl-、
,②H+、Cl-、![]() ,③Na+、K+、OH-,④Na+、K+、
,③Na+、K+、OH-,④Na+、K+、![]() ,其中按照仅由酸、碱、盐依次电离的是( )
,其中按照仅由酸、碱、盐依次电离的是( )
A. ②③④ B. ②①④
C. ②③① D. ②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com