
【题目】对于可逆反应mA(g)+nB(s)![]() pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )

A.降温,化学平衡向逆反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m<p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

A. a极与电源的负极相连
B. a电极反应式:2H2O+2e-= H2↑+2OH-
C. 离子交换膜d为阴离子交换膜
D. 产物丙为硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
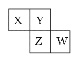
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B. 以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
D. 钢铁发生吸氧腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去燃煤烟气中的有毒气体,一直是重要的科研课题。某科研小组设计如下装 置模拟工业脱硫脱氮,探究SO2和NO同时氧化的吸收效果。模拟烟气由N2 (90.02%)、SO2(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。已知:FeSO4+NO![]() [Fe(NO)]SO4(棕色)
[Fe(NO)]SO4(棕色)

(l)仪器A的名称是____,该装置出气管口有两个玻璃球泡,其作用是____。
(2)反应前装置中需要先通入一段时间N2,目的是____,其操作方法是____。
(3)实验中A瓶出现黑色沉淀,写出 A瓶中脱硫反应的离子方程式____。继续实验,现B瓶溶液颜色不变、C瓶溶液出现棕色,这些现象说明____。
(4)关闭活塞e,打开活塞d,在其出气管口,用NO检测仪研究A在不同温度时的脱氮率,实验结果如下图所示,分析图中信息,得出的结论是____。在55℃之前,脱氮率随温度升高而变化的原因可能是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )
A. HB—水解方程式:HB-+H2O![]() H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
C. NaHB的存在抑制了水的电离 D. 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的反应化学方程式如下:(用元素符号或化学式表示)
MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O
(1)还原剂是:______;氧化产物是 _________;
(2)被氧化的原子与被还原的原子个数之比为____
(3)请用双线桥法表示反应的电子转移方向和数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com