

| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:不详 题型:问答题
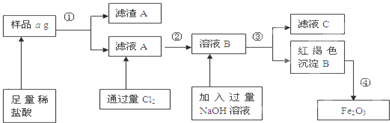
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
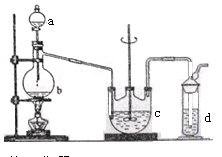
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 起始读数 滴定前 | 终点读数 | ||
| 1 | 20.00 | 0.50 | 20.40 |
| 2 | 20.00 | 6.00 | 26.10 |
| 3 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
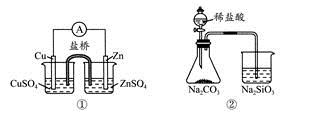
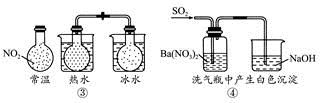
| A.①能组成Zn-Cu原电池 |
| B.②能证明非金属性Cl>C>Si |
C.③说明反应2NO2(g) N2O4(g),ΔH<0 N2O4(g),ΔH<0 |
| D.④白色沉淀为BaSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
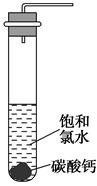
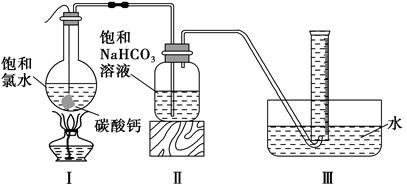
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
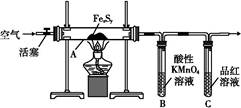
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
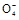 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S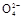 +4H+
+4H+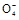 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O| 编号 | 温度/℃ | 酸化的H2C2O4 溶液/mL | KMnO4 溶液/mL | 溶液褪 色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶 于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
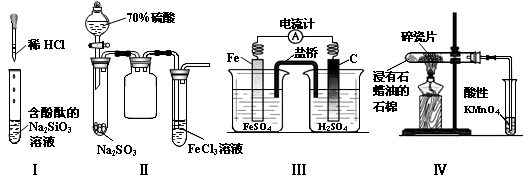
| A.实验Ⅰ试管中红色溶液逐渐变成无色溶液 |
| B.实验Ⅱ试管中出现淡黄色浑浊 |
| C.实验Ⅲ铁棒上有无色气泡产生 |
| D.实验Ⅳ中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com