
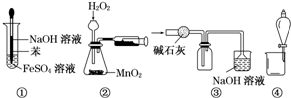
| A. | 图①可以用来制取Fe(OH)2沉淀 | |
| B. | 图②可以用来测定化学反应速率 | |
| C. | 图③可以用来收集一瓶纯净的SO2 | |
| D. | 图④可以用来分离水和乙醇的混合溶液 |
分析 A.氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁,制备时应隔绝空气;
B.长颈漏斗应插入液面以下;
C.二氧化硫可被碱石灰吸收;
D.水和乙醇混溶.
解答 解:A.氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁,苯的密度小于水,所以可以用苯隔绝空气的干扰,故A正确;
B.气体从长颈漏斗逸出,不能测定反应思路,可先加入水,使长颈漏斗应插入液面以下,或用分液漏斗,故B错误;
C.二氧化硫可被碱石灰吸收,不能收集到二氧化硫,故C错误;
D.水和乙醇混溶,不能用分液的方法分离,一般用蒸馏的方法,故D错误.
故选A.
点评 本题考查实验方案评价,为高频考点,侧重考查基本操作及物质性质,明确实验原理及仪器的使用方法是解本题关键,注意从操作的规范性及物质性质方面解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
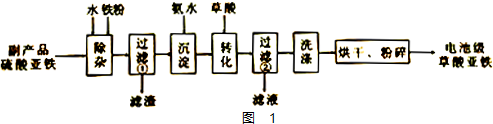
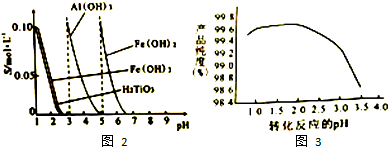
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷和氢氧化钠溶液混合共热 | |
| B. | 一氯甲烷和苛性钠的乙醇溶液混合共热 | |
| C. | 氯苯与氢氧化钠溶液混合共热 | |
| D. | 1-溴丁烷与氢氧化钾的乙醇溶液混合共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 | |
| B. | 钠都要浮在水面上或乙醇液体表面 | |
| C. | 钠无论与水反应还是与乙醇反应都要放出热量 | |
| D. | 钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com