
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。若测定结果偏高,其原因可能是_____。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
D.滴定管滴定前无气泡,滴定后有气泡
(2)判断滴定终点的现象是________。
(3)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(4)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
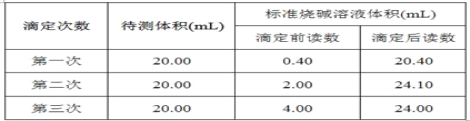
【答案】① AB 滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色 22.60 0.200 0
【解析】
(1)根据碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准盐酸溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() ,可知c(标准)偏大,
,可知c(标准)偏大,
A.配制标准溶液的固体NaOH中混有KOH杂质,标准溶液中氢氧根离子的浓度偏小,消耗的V(标准)增大,c(待测)=![]() 分析,测定结果偏高,故A正确;
分析,测定结果偏高,故A正确;
B.滴定终点读数时,仰视滴定管的刻度,读取消耗的V(标准)偏大,c(待测)=![]() 分析,测定结果偏高,故B正确;
分析,测定结果偏高,故B正确;
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗,对滴定的数据结果无影响,故C错误;
D.所配的标准NaOH溶液物质的量浓度偏大,滴定过程中溶液变红色早,消耗的V(标准)偏小,c(待测)=![]() 分析,测定结果偏低,故D错误;
分析,测定结果偏低,故D错误;
故答案为:①;AB;
(2)滴定终点时溶液颜色由无色突变为红色,且半分钟内不褪色,判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色;
故答案为:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不褪色;
(3)依据滴定管构造及精确度可知图中液面读数为:22.60;
故答案为:22.60;
(4)三次消耗标准液体积分别为:20.00,20.00,22.10,第三组数据误差较大,应舍弃,则消耗标准液平均体积为:20.00mL,待测液浓度为:![]() =0.2000mol/L;
=0.2000mol/L;
故答案为:0.2000。


科目:高中化学 来源: 题型:
【题目】法匹拉韦(Favipiravir)是一种RNA聚合酶抑制剂,被用于治疗新型和复发型流感,主要通过阻断病毒核酸复制的方法抑制病毒增殖,其结构如图。下列关于法匹拉韦的说法错误的是( )

A.分子式为C5H4FN3O2
B.所有原子可能在同一平面上
C.所有碳原子的杂化方式都是sp2杂化
D.一定条件下能与氢氧化钠溶液、盐酸、氢气等发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定时,眼睛观察锥形瓶中溶液颜色的变化
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。
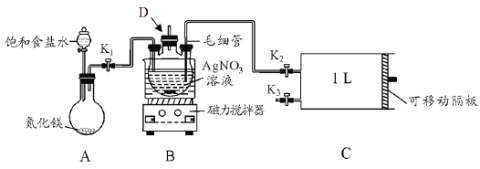
I.配制银氨溶液
⑴盛装AgNO3溶液的仪器D的名称_____________。
⑵关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式_________;饱和食盐水的用途是________。
Ⅱ.测定室内空气中甲醛含量
⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_______________。
⑷装置中毛细管的作用是________________。
⑸已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为_______mg.L-1(空气中其它物质不与银氨溶液反应)。
⑹该设计装置存在一个明显的不足之处是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。

(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。

(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。
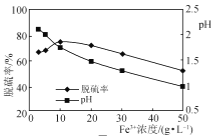
①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com