
分析 (1)元素化合价降低发生还原反应;
(2)NaNO2把人体内的Fe2+转化为Fe3+,Fe元素的化合价升高,则N元素的化合价降低,说明亚硝酸钠具有氧化性;
(3)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为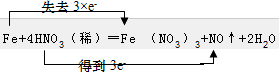 ;
;
①:HNO3表现了酸性和氧化性;
②:计算:当有28g Fe的物质的量为:$\frac{28g}{56g/mol}$=0.5mol,
i:由反应方程式可知:被还原的HNO3的物质的量等于铁的物质的量;
ii:转移电子数为:0.5mol×3=1.5mol;
ⅲ:生成 NO气体的物质的量为0.5mol.
解答 解:(1)A.Fe2+→Fe3+ 元素化合价升高,发生氧化反应,故不选;
B.Fe→FeCl2元素化合价升高,发生氧化反应,故不选;
C.FeCl3→Fe(OH)3 元素化合价不变,故不选;
D.Fe2O3→Fe元素化合价降低发生还原反应,故选;
故选D;
(2)NaNO2把人体内的Fe2+转化为Fe3+,Fe元素的化合价升高,则N元素的化合价降低,NaNO2具有氧化性,故答案为:氧化;
(3)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为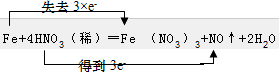 ;
;
①:HNO3表现了酸性和氧化性,故答案为:酸性;氧化性;
②:计算:当有28g Fe的物质的量为:$\frac{28g}{56g/mol}$=0.5mol,
i:由反应方程式可知:被还原的HNO3的物质的量等于铁的物质的量,答:被还原的HNO3为0.5mol;
ii:转移电子数为:0.5mol×3=1.5mol,答:转移电子数为1.5mol;
ⅲ:生成 NO气体的物质的量为0.5mol,气体体积为:0.5mol×22.4L/mol=11.2L,答:生成11.2L的 NO气体.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的基本概念即可解答,注意硝酸的作用为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:
某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
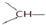 和一个-OH,它的可能结构式有( )
和一个-OH,它的可能结构式有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 升温可让吸热反应加快速率,而会让放热反应减慢速率 | |
| D. | 通过增大浓度、升高温度、增大压强都可以使反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 | |
| D. | 除去甲烷中混有的少量乙烯:将混合气体通入酸性KMnO4溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
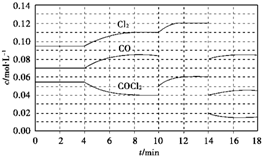
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: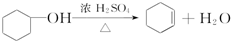
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com