
分析 由①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
结合盖斯定律可知,①-②得到2CO(g)+2NO(g)═N2(g)+2CO2(g),以此来解答.
解答 解:由①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
结合盖斯定律可知,①-②得到2CO(g)+2NO(g)═N2(g)+2CO2(g),
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H=(-566kJ•mol-1)-(+180kJ•mol-1)=-746 kJ•mol-1,
故答案为:-746 kJ•mol-1.
点评 本题考查反应热与焓变,为高频考点,把握反应与焓变的关系为解答关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
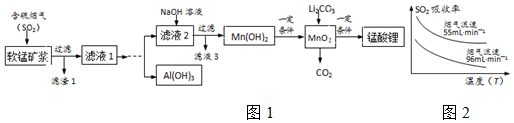
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 | |
| C. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4的沸点比P4(白磷)的高 | |
| C. | 理论上可以将N4转化为N2的反应设计成原电池 | |
| D. | 1mol N4所含有的能量比2mol N2所含有的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-+OH-═CO32-+H2O | |
| B. | Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | CO32-+Ca2+═CaCO3↓ | |
| D. | Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题



| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
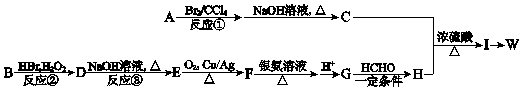
 ).
).
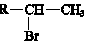
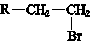
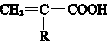 (R-代表烃基)
(R-代表烃基)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸与铝不反应,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 常温下二氧化硅不与任何酸反应,可用石英容器盛放氢氟酸 | |
| C. | 铝热反应原理是炼铁最常用的反应原理 | |
| D. | 氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com