
| A. | Na2CO3溶液与澄清石灰水的反应 | |
| B. | 氢氧化铜与稀硫酸的反应 | |
| C. | 锌与氯化铜溶液的反应 | |
| D. | 二氧化碳与生石灰作用生成碳酸钙的反应 |
分析 A、Na2CO3溶液与澄清石灰水的反应是盐和碱发生的反应,是复分解反应;
B、氢氧化铜与稀硫酸的反应是碱和酸的反应,属于复分解反应;
C、锌与氯化铜溶液的反应是金属和盐溶液发生的置换反应;
D、二氧化碳与生石灰作用生成碳酸钙的反应是气体和固体发生的化合反应;
解答 解:A、Na2CO3溶液与澄清石灰水的反应是盐和碱发生的反应,是复分解反应,实质是碳酸根离子和钙离子生成碳酸钙沉淀的离子反应,故A不符合;
B、氢氧化铜与稀硫酸的反应是碱和酸的反应,属于复分解反应,实质是铜离子和氢氧根离子生成氢氧化铜沉淀的离子反应,故B不符合;
C、锌与氯化铜溶液的反应是金属和盐溶液发生的置换反应,实质是锌还原氯化铜溶液中的铜离子生成单质铜的离子反应,故CA不符合;
D、二氧化碳与生石灰作用生成碳酸钙的反应是气体和固体发生的化合反应,不是溶液中的离子反应,故D符合;
故选D.
点评 本题考查了离子反应的实质理解和反应过程的理解应用,掌握基础是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+═H2O+CaCO3↓ | |
| B. | 氯化铵与氢氧化钠溶液混合:NH4++OH-═H2O+NH3↑ | |
| C. | 向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| D. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | 每还原1mol NO3-,需氧化1mol Zn和1mol NH4+ | |
| C. | 生成的烟中含有ZnO和NH4NO3 | |
| D. | 生成的白烟是N2溶于水形成的小液滴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
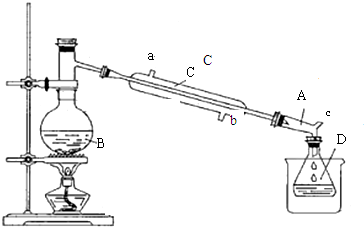
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com